Prise en charge des patients après un cancer : intérêt de l’activité physique
Les patients traités pour un cancer sont susceptibles de présenter plusieurs situations pathologiques lors de leur suivi : pathologie tumorale (rechute ou deuxième cancer), troubles de l’humeur, fatigue, comorbidités cardiovasculaires ou ostéoarticulaires, prise de poids. L’activité physique (AP) modifie ces risques avec des mécanismes d’action connus.
Impact de l’AP sur la fatigue
La fatigue est décrite par la quasi-totalité des patients porteurs de maladie cancéreuse (1), sa prévalence est de 70 à 90 % et ce tant au début de la prise en charge qu’à distance des traitements (2, 3) affectant de façon majeure la qualité de vie des patients. La définition retenue est celle du National Comprehensive Cancer Network (NCCN) (4) décrivant une sensation subjective d’épuisement physique, émotionnel ou cognitif en relation avec le cancer et ses traitements qui n’est pas proportionnel avec une activité physique récente, qui ne cède pas au repos et qui interfère avec les gestes quotidiens de la vie.
Plusieurs échelles de mesure, proposées pour évaluer l’existence et l’importance de cette fatigue, sont simples et rapides à utiliser (échelle visuelle analogique VAS (5), BFI (6)) ou plus longues et complexes (FACT F, MFSI (6, 7)) avec des renseignements plus complets (5).
Cette fatigue est associée à des phénomènes psychologiques, des effets secondaires des traitements, du cancer (inflammation, douleurs, anorexie, perte de poids, dyspnée…), des comorbidités (anémie, hypothyroïdie, hypogonadisme, insuffisance cardiorespiratoire…).
La fatigue liée au cancer est majoritairement due à un déconditionnement physique ou une désadaptation à l’effort résultant d’une perte d’activité physique dès la prise en charge du cancer (congé maladie, alitement, chirurgie, radiothérapie, chimiothérapie…). La fatigue liée au cancer est associée à une diminution de la force et de la masse musculaire squelettique (8). Le mécanisme, périphérique au niveau musculaire ou central cérébral, de cette réduction de force musculaire n’est pas connu (9).
La recherche de la fatigue doit être systématique lors du diagnostic et des soins en utilisant des tests simples et rapides (VAS ou BFI) (10). En cas de diagnostic de fatigue, il faut éliminer les causes classiques de fatigue (hypothyroïdie, anémie, diabète, insuffisance cardiorespiratoire, bêtabloquants…). La prise en charge va dépendre du niveau d’intensité de la fatigue : faible, moyenne ou forte (5). Deux modalités de soins existent : pharmacologiques ou non. Les traitements pharmacologiques (méthylphénidate, modafinil) n’ont pas fait preuve d’efficacité. Les soins non pharmacologiques (thérapies cognitivo-comportementalistes, gestion du sommeil et des efforts du quotidien, exercice) ont en revanche démontré une véritable action thérapeutique sur la fatigue liée au cancer.
L’activité physique permet d’améliorer la fatigue quel que soit le moment de la prise en charge du cancer. Trois méta-analyses récentes d’essais randomisés ont évalué le bénéfice de l’AP pour traiter la fatigue aux différents moments de la prise en charge du patient cancéreux (11-13). Les conclusions de ces méta-analyses permettent de positionner l’AP avec un niveau de preuve de grade A dans cette situation et ce, quels que soient le type de cancer (résultats globaux puis par sous-type de cancer), le moment de prise en charge (pendant ou à distance des traitements), et le type d’activité réalisée (aérobie ou anaérobie) (11). Les résultats globaux (tous cancers, tous stades) montrent une réduction de 25 % du niveau de fatigue, et de 35 % pour les cancers du sein. Ce bénéfice existe tant sur la fatigue pendant le traitement (réduction du niveau de fatigue de 20 %), qu’après la fin des traitements (réduction de 40 %). En revanche, une supervision directe est indispensable ; un soutien téléphonique seul (14) ne retrouve aucun bénéfice d’une prescription de l’AP. Des recommandations pour la pratique de l’AP comme moyen de traitement de la fatigue liée au cancer existent (AFSOS, NCCN (15)) (Encadré 1, Tab. 1).
Encadré 1 – Résumé des recommandations concernant l’APA pour traiter la fatigue liée au cancer (d’après le référentiel du Réseau Régional de Cancérologie Rhône-Alpes et validé par l’AFSOS).
Réhabilitation physique +++
Effet bénéfique de l’activité physique sur le niveau de fatigue +++ (diminution ~ 20-30 %)
• Planifier une activité physique adaptée (APA) dès le début de prise en charge
• Un traitement spécifique en cours (chimiothérapie, radiothérapie…) ne doit pas constituer (sauf exception) un frein pour commencer une APA
• Activité rythmique aérobie adaptée au patient, progressive (exemple : marche, aquagym, gymnastique douce, vélo, activité en salle, etc.)
• Intensité modérée à soutenue, aérobie (55 à 75 % de la FC max ; FC max = 220 – âge)
• Recommandation d’au moins 30 min d’APA (idéalement 45 à 60 min) au moins 2 à 5 fois par semaine
• Nécessité d’un personnel qualifié (professeur STAPS, option APA ou Brevet d’Etat du ministère des Sports, avec formation spécifique en cancérologie)
• Programme réalisé au sein d’un groupe de patients
• Programme individualisé prenant en compte :
– le stade de la maladie
– les traitements prévus
– les capacités physiques du sujet
– ses préférences sur le type d’exercice
– son état psychologique
• Rechercher et éliminer les contre-indications :
– altération psychique importante
– cachexie sévère – troubles cardio-pulmonaires
– métastases osseuses à risque ou cérébrales
• Nécessité d’un certificat médical d’aptitude
Attention :
– à la population métastatique (fragilité osseuse, etc.)
– à l’anémie
– à la thrombopénie
– à la fièvre
– à la neutropénie
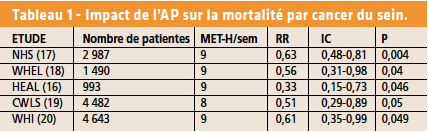
Bénéfices de l’activité physique en cancérologie sur la survie
Les données concernent les cancers les plus fréquents : sein, côlon et prostate.
Activité physique et survie après cancer du sein
Cinq cohortes de femmes porteuses de cancer du sein localisé et non évolutif, évaluées de façon prospective, (16-20) retrouvent une association entre AP post-traitement et diminution des risques de décès par cancer du sein mais aussi par d’autres causes. Le maintien d’une AP hebdomadaire au-delà de 8 à 9 MET-heure est associé à une réduction de près de 50 % du risque de décès par cancer (Fig. 1). Le bénéfice en termes de survie à 5 ans et à 10 ans est alors de 4 et de 6 %. La réduction du taux de rechute augmente avec le niveau d’exercice jusque vers 20 MET-heure. Ce bénéfice existe tant pour la survie spécifique que globale (21).
Des biais méthodologiques évidents existent dans ces études prospectives non randomisées. Mais ce gain de survie en cas d’AP existe en analyse multivariable intégrant les facteurs pronostiques classiques.
Une méta-analyse (22) retrouve que l’AP après le diagnostic de cancer du sein est associée à une réduction du risque de décès par cancer du sein (RR = 0,66 [0,57-0,77] p < 0,00001) ainsi qu’à une réduction du risque de décès toutes causes confondues (RR = 0,59 [0,53-0,65] p < 0,00001) et à une réduction du taux de rechute du cancer (RR = 0,76 [0,66-0,87] p = 0,00001). Le bénéfice sur la survie de l’AP post-diagnostic existe en cas de BMI > 25 (RR = 0,53 [0,35-0,81]) mais pas en cas de BMI < 25. Le bénéfice en survie existe en cas de formes RH + avec une valeur limite (RR = 0,36 [0,12-1,03] p = 0,06) mais pas dans les formes RH-.
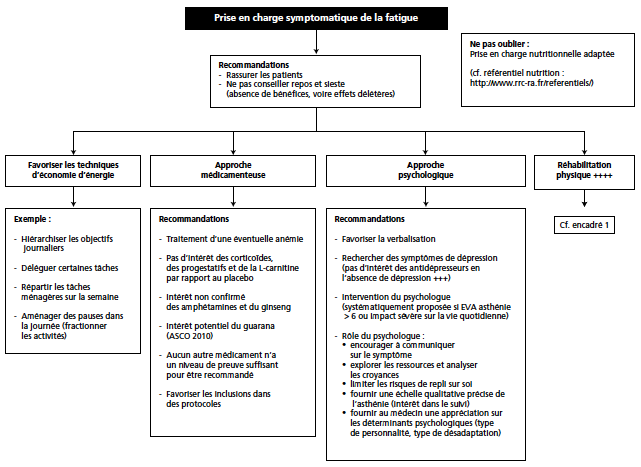
Figure 1 – Prise en charge globale de la fatigue du patient cancéreux (d’après le référentiel du Réseau Régional de Cancérologie Rhône-Alpes et validé par l’AFSOS).
Bénéfices en termes de survie sur d’autres néoplasies que le cancer du sein ?
• Impact sur la survie après cancer colique
Quatre cohortes de patients porteurs de cancers coliques non métastasés et contrôlés avec un suivi retrouvent une corrélation entre survie globale et spécifique et la réalisation d’une activité physique (Tab. 2) (23-26). En revanche, ce bénéfice n’existe pas pour les cancers du rectum (27).
• Impact sur la survie des cancers de prostate
La cohorte NHS (28) en analyse multivariable retrouve des risques relatifs de mortalité spécifique et globale réduits selon le niveau (< 9 vs > 9 MET-h/ sem) et la durée hebdomadaire d’activité physique (< 1 h/sem vs > 3) (Fig. 2).
Cette analyse multivariable intègre l’âge, Gleason, TNM, IMC, régime, existence d’un diabète, race, AP avant le diagnostic. La pratique régulière d’une AP suffisamment intense au décours de plusieurs cancers (sein, côlon, prostate), qui représentent les incidences les plus élevées en dehors des cancers induits par le tabac, est associée à une réduction du risque de rechute et de décès avec un risque relatif homogène d’une série à l’autre et d’un cancer à un autre de l’ordre de 50 %.
Cette relation correspond à des modifications métaboliques induites par l’AP.
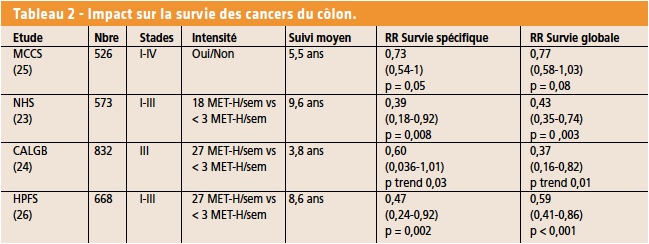
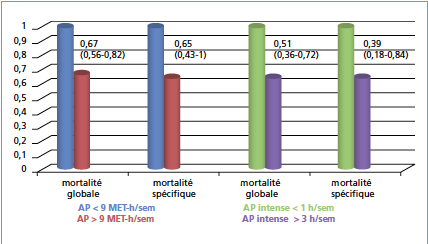
Figure 2 Impact de l’AP sur la survie des cancers de prostate.
Mécanismes d’action de l’AP
L’AP modifie plusieurs paramètres biochimiques impliqués dans le métabolisme des cellules cancéreuses mammaires.
Action sur les oestrogènes
En post-ménopause, l’AP diminue les taux d’oestrogènes libres (29, 30). L’essai randomisé d’Alberta (31) chez des femmes sédentaires post-ménopausiques, sans antécédent de cancer ou d’autre pathologie sévère, et susceptibles de participer à des activités physiques, met en évidence une diminution de l’oestradiol et une augmentation du taux de SHBG. Cet effet de l’AP sur le taux d’oestrogène n’est pas retrouvé dans un autre essai (32).
Action de l’activité physique sur l’insuline et l’IGF-1
Un taux élevé d’insuline ou de peptide C lors du diagnostic d’un cancer du sein sont des facteurs de mauvais pronostic (33-35). L’insuline est un facteur de croissance des cellules cancéreuses, augmente les estrogènes libres en post-ménopausique (36, 37). L’activité physique réduit les sécrétions d’insuline et d’IGF-1 et abaisse l’insulino-résistance (38-40).
Action de l’activité physique sur les sécrétions issues des tissus graisseux Les adipocytes secrètent des adipokines, la leptine, mitogène, et l’adiponectine, pro-apoptotique (41). Chez les femmes suivies pour un cancer du sein localisé en rémission complète, l’insulino-résistance et les adipokines sont corrélées entre elles et avec la mortalité spécifique par cancer du sein. Un taux élevé d’adiponectine est associé à une réduction de la mortalité spécifique (42). L’activité physique accroît la sécrétion d’adiponectine et réduit la leptine (43) ce qui s’ajoute à son action sur l’insulino-résistance. L’AP modifie les sécrétions d’insuline, d’oestrogène et des adipokines, ce qui modifie la croissance tumorale.
Difficultés de réalisation de l’AP en oncologie
Deux difficultés principales interviennent. D’une part, motiver les patients à pratiquer l’AP et, d’autre part, évaluer et définir les types d’exercice à mettre en place. Les patients, au décours du diagnostic de cancer, réduisent de façon importante leurs activités physiques (44) par la crainte qu’une activité physique ne produise douleur, blessure. Cette peur du mouvement, mesurable par la Modified Tampa Scale of Kinesiophobia-Fatigue (45), doit être prise en charge pour accroître la participation des patients. L’autre difficulté vient du modèle pratique d’activité physique à mettre en place. Les différentes analyses retrouvent une association entre la pratique d’une AP et les niveaux de fatigue et de rechute. Mais ces analyses se font sans préciser les modalités pratiques, les objectifs de l’activité physique, et le respect des programmes et suivis (46). Ce flou des méthodes pratiques explique probablement un certain nombre de résultats négatifs, limite la valeur scientifique des recommandations d’AP et nécessitera la mise en place d’essais comportant une méthodologie précise de l’activité physique avec une définition des buts, populations, modalités et réalisation pratique homogènes.
Conclusion
Bien qu’ayant un impact majeur sur la fatigue et la survie après les soins, la réhabilitation physique doit s’intégrer dans une prise en charge globale n’oubliant pas la correction des troubles nutritionnels, la hiérarchisation des activités quotidiennes (favoriser les techniques d’économie d’énergie), l’approche psychologique et l’abord médicamenteux quand cela est justifié (anémie…). Ces éléments se trouvent dans l’encadré 1.
Ces données plaident pour le positionnement dans les services d’oncologie d’un enseignant d’AP pour éduquer les patients sur la réhabilitation physique. Le but de ce professionnel formé sera d’organiser la prévention et la prise en charge dès la phase des traitements (c’est-à-dire la phase hospitalière) le plus tôt possible chez les patients et de suivre la poursuite ultérieure de l’AP. Il apparaît, en outre, indispensable de réfléchir dès à présent à la formation spécifique de ces enseignants du fait des difficultés particulières rencontrées au sein de la population de patients atteints de cancer (psycho-oncologie, modification du schéma corporel, difficultés liées aux traitements…), par exemple au travers du modèle du diplôme interuniversitaire “sport et cancer” de Paris 13.



