Tendinopathie et rupture du tendon d’Achille : évaluation radiologique
La pathologie achilléenne tendineuse est fréquente mais nécessite en cas d’aggravation des symptômes une évaluation radiologique rapide de la sévérité des lésions pour prévenir le stade ultime qu’est la rupture tendineuse. « Le diagnostic de rupture est clinique et repose sur deux signes pathognomoniques : la perte de l’équin physiologique et le signe de Thompson » pour les auteurs du traité sur les ruptures du tendon achilléen de l’Encyclopédie médico-chirurgicale (1), mais de rajouter qu’« il ne faut pas accepter le diagnostic erroné de rupture partielle, porté par des examens radiologiques complémentaires » ! Doit-on en conclure que les ruptures partielles n’existent pas ?
Le tendon calcanéen
Rappel anatomique
Le tendon calcanéen prolonge la réunion des muscles gastrocnémiens médial et latéral et du soléaire, formant le triceps sural, pour s’insérer sur le versant postéro-supérieur du calcaneus.
Le complexe suro-achilléo-calcanéo- plantaire serait uni par une fine lame fibreuse recouvrant le calcaneus en arrière, expliquant les atteintes synchrones que l’on peut observer à la fois sur l’insertion aponévrotique plantaire et le tendon calcanéen (Fig. 1).
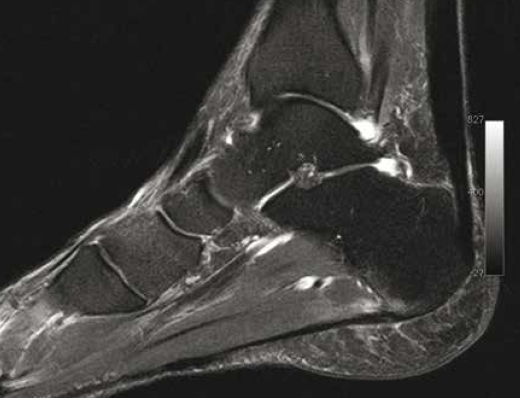
Figure 1 – IRM sagittal T2fatsat. Tendinopathie achilléenne chronique chez un marathonien, avec atteinte synchrone de l’aponévrose plantaire.
Des fascias superficiels s’étendent de manière proximale, entre les muscles soléaire et gastrocnémiens, expliquant dans les ruptures hautes, la suffusion hématique à l’interface de ces différentes structures. La longueur moyenne du tendon achilléen est de l’ordre de 15 cm, avec des extrêmes observés de 11 à 26 cm (2). Une variante anatomique avec jonction myotendineuse basse est à noter car elle peut constituer un facteur favorisant de tendinopathie.
Le tendon calcanéen est constitué de fibrilles régulières organisées dans le plan transverse en “boomerang” concave en avant, de diamètre antéro-postérieur normalement inférieur à 6 mm. Le tendon mesure environ 6,8 cm de large à son origine, s’amincissant progressivement à sa partie moyenne.
La contribution en proportion des muscles gastrocnémiens et soléaire est relativement identique. Dans une série anatomique, elle est de l’ordre de 50 % dans 87 % des cas, avec une proportion plus grande des fibres provenant des gastrocnémiens dans les 13 % restant (3). Il existe une rotation des fibres selon une spire de l’ordre de 90°, cette rotation étant plus importante en cas de jonction myotendineuse plus basse (4).
Un tissu cellulo-adipeux compact l’entoure, le sépare du derme en arrière, et constitue en avant le triangle graisseux de Kager.
À l’insertion, il existe une petite bourse de glissement dans le triangle anatomique séparant le rebord postéro-supérieur du calcaneus de l’insertion tendineuse. Le tendon achilléen ne présente pas de véritable gaine synoviale mais un fin péritendon.
Histologie
Les ténocytes constituent avec les ténoblastes 90 à 95 % des composantes cellulaires du tendon. Des cellules vasculaires, synoviales, des chondrocytes, et des cellules de muscles lisses constituent les 5 % restant.
Les fibres de collagène constituent 70 % de la matrice extracellulaire et les fibres d’élastine, 2 % (2). Ces fibres de collagène s’organisent en fascicules innervés et vascularisés, entourés d’un endo-tendon, l’ensemble formant le tendon macroscopique. Un épitendon lui même entouré d’un paratendon les recouvre en périphérie, séparés l’un de l’autre par une fine couche de fluide.
Il n’existe pas à proprement dit de gaine synoviale puisqu’il n’existe pas de coulisse tendineuse (2). Les fibres de collagène de type I forment 90 % du tendon normal. Mais, lors des microruptures tendineuses, les ténocytes produisent essentiellement des fibres de collagène de type III, moins résistantes aux forces de contrainte.
Des mesures in vivo montrent que des contraintes majeures sont appliquées au tendon achilléen. La course à pied occasionne une application de force de 9 KN sur le tendon, soit l’équivalent de 12,5 fois le poids du corps. Même la marche entraîne des contraintes importantes (2,6 KN) (2, 5, 6).
Au repos, le tendon a une configuration en vague de ces fibrilles de collagènes qui disparaît dès lors que l’étirement du tendon est de plus de 2 %. La configuration en vague au repos peut se reconstituer tant que cet étirement n’excède pas 4 % de la longueur du tendon. Au-delà de 8 %, des ruptures macroscopiques apparaissent (2).
Biomécanique et physiopathologie des lésions
Les lésions tendineuses sont une atteinte classique des sportifs comme des travailleurs représentant jusqu’à 30 à 50 % des lésions liées à une pratique sportive (7, 8).
Plusieurs études ont montré que la fréquence de répétition d’un même geste constitue un facteur de risque des lésions tendineuses. Un sportif ou un travailleur répétant toujours le même mouvement présente un risque deux à trois plus élevé de développer des douleurs et une tendinopathie.
Il existe donc une relation linéaire entre d’une part le risque de tendinopathie, et d’autre part la vitesse et la fréquence de contraction. Les études sur des modèles animaux de la micro-architecture tendineuse, comparant des tendons soumis à des contractions répétées, confirment l’apparition de microruptures et la modification de la densité tendineuse lorsque la fréquence des contractions augmente. Avec des pics de force identique, une fréquence de répétition plus rapide des contractions cause un plus grand nombre de microclivages (7, 8).
D’autres auteurs ont montré des modifications macro-anatomiques du calibre tendineux. Après 4 semaines d’effort mécanique intense (1 h par jour, 5 jours par semaine), on observait une augmentation de la surface de section tendineuse mais également une diminution de l’élasticité tendineuse, en comparaison au groupe témoin (9, 10). Perry et al. (11) ont montré l’augmentation de l’expression mRNA, de marqueurs inflammatoires (Cox-2 et Flap) et des facteurs angiogéniques (VEGF, VWF) après seulement 3 jours d’exercice.
Toujours sur le modèle animal, il a été observé une répartition topographique particulière des microruptures qui semblent prédominer sur le versant enthésique distal du tendon, en périphérie. Ces auteurs rappellent que la portion périphérique du tendon est majoritairement composée de fibres de collagène de type I dont les propriétés sont différentes des fibres essentiellement fibro-cartilagineuses qui constituent la portion plus profonde et centrale du tendon. Ces dernières résisteraient peut-être mieux aux étirements répétés.
L’exercice augmente la synthèse de collagène, mais de fibres de plus petit diamètre, sans pont intermoléculaire, qui nécessitent un processus de maturation par stimulation enzymatique plus long (7, 12). Chez l’homme, une étude échographique comparant des tendons d’Achille chez 16 athlètes symptomatiques et 19 athlètes volontaires asymptomatiques montre la présence de microclivages prédominant au tiers moyen du tendon. Soixante-sept pour-cent des tendons contrôles étaient normaux et 28 % de ces tendons contrôles ne présentaient qu’un microclivage unique (13). La présence de microclivages, y compris dans le groupe asymptomatique, s’explique par le fait que le tissu tendineux est en constant remodelage. Un processus de réparation continu des microlésions proche de celui du remodelage osseux et proportionnel aux forces de contraction qui lui sont appliquées (loi de Wolfe) explique pourquoi chez l’athlète le tendon est souvent plus épais (Fig 1).
La localisation des microclivages de manière nettement préférentielle au tiers moyen du tendon est liée à l’existence d’une zone relativement avasculaire du tendon achilléen. Une diminution des capacités de cicatrisation de cette région, qui ne se fait que par vaisseaux perforants provenant du paratendon, peut expliquer qu’en cas de microtraumatisme, la supplémentation en oxygène diminue. Autrement dit, en cas d’augmentation des contraintes tendineuses, il existe à la fois une augmentation du nombre des microclivages intratendineux et une diminution de la capacité de réparation de ces microclivages. Ce cercle vicieux conduit progressivement à l’apparition d’une rupture partielle puis éventuellement complète du tendon.
Il existe donc un spectre linéaire, du tendon normal à la rupture complète, sans véritable critère pour différencier ces stades histologiques, d’où la difficulté de les distinguer en imagerie (13).
Diagnostic des atteintes du tendon calcanéen
Examen clinique
La manoeuvre de Thompson est extrêmement spécifique dans le diagnostic différentiel de rupture complète versus rupture partielle ou tendinopathie (14). La pression des masses musculaires du triceps sural entraîne une flexion plantaire si le tendon calcanéen est toujours continu.
Les ruptures partielles comme complètes sont liées à des traumatismes indirects, mais plus souvent à des microtraumatismes répétés aggravant une tendinopathie chronique d’où l’absence de signe clinique de rupture partielle en dehors de l’aggravation bruyante d’une symptomatologie de fond.
En cas de tendinopathie chronique, l’épaississement fusiforme du tendon peut entraîner à la palpation la sensation d’un pseudo-nodule tendineux correspondant à la zone pathologique sur son versant postérieur. Une bursite rétrocalcanéenne par conflit avec la chaussure est plus fréquente en cas d’atteinte distale
Imagerie
Le tendon normal
Il prolonge les deux lames tendineuses des gastrocnémiens ainsi que le corps du soléaire dont les fibres se poursuivent respectivement sur le versant latéral et médial du tendon. Il est facilement étudié en échographie du fait de sa position superficielle, séparé du derme en arrière par quelques millimètres seulement.
Le tendon calcanéen normal :
• mesure moins de 6 mm de diamètre
antéro-postérieur ;
• mesure une dizaine de centimètres
de hauteur ;
• a ses bords parallèles ;
• a un aspect concave en avant,
en boomerang.
Une étude échographique dynamique en flexion plantaire et dorsale est systématique afin de ne pas méconnaître les microclivages intratendineux qui sont masqués en flexion dorsale. L’étude Doppler puissance ne montre pas de flux normalement détectable.
Tendinopathies et ruptures partielles
En imagerie, le tendon est épaissi, de plus de 6 mm de diamètre antéro- postérieur (Fig 2).

Figure 2 – Tendinopathie fusiforme en échographie. Le diamètre antéro-postérieur est augmenté de manière bilatérale et asymétrique, avec une perte de la concavité antérieure en axiale.
Mais les critères différenciant les tendinoses des ruptures partielles sont flous.
Il existe quatre types de dégénérescences tendineuses :
• fibromateuse ou hypoxique ;
• lipoïde ;
• ossifiante ou calcifiante ;
• myxoïde (5).
Ces différents types de lésions entraînent l’apparition de microclivages qui, par coalescence, vont former des plages de dégénérescence mucoïde et de rupture interstitielle le long de l’axe principal du tendon.
La dégénérescence fibreuse, également appelée tendinopathie dégénérative hypoxique, est la forme la plus fréquente conduisant aux ruptures tendineuses.
Radiographie
Une radiographie de cheville de profil peut montrer, en cas de tendinopathie, un épaississement en fenêtre molle du calibre du tendon. La présence de microcalcifications en projection du tendon peut témoigner de micro- ou macroruptures plus ou moins chroniques (Fig. 3).

Figure 3 – Calcification en projection du tendon d’Achille. Rupture ancienne cicatrisée.
La graisse de Kager est souvent comblée en cas de poussée inflammatoire ou de rupture récente. On analysera l’insertion calcanéenne à la recherche d’enthésophyte ossifié, témoin d’une atteinte distale chronique, et une éventuelle déformation d’Haglund.
Échographie vs IRM
L’IRM montre en général un épaississement tendineux avec hyposignal fibreux T1 et T2 du tendon (Fig. 1). Dans le second type de dégénérescence le plus fréquent, mucoïde, on observe des hypersignaux punctiformes T2. Progressivement, de véritables kystes intratendineux peuvent apparaître et dans certains cas une dégénérescence mucoïde “silencieuse” peut être objectivée, à l’origine de ruptures partielles chroniques (5) (Fig. 4).

Figure 4 – Rupture partielle de type mucoïde avec une large plage de clivage intratendineux en hypersignal T2.
Dans une étude sur la distinction échographique entre les ruptures partielles et totales, Hartgreink et al. regroupent ensemble les ruptures partielles et les tendinoses évoluées versus un groupe de ruptures complètes (15). Les critères de rupture complète sont ceux retenus habituellement mais les critères ayant permis de distinguer une tendinose d’une rupture partielle ne sont pas précisés.
Pour certains auteurs comme Aström et al., un tendon de plus de 10 mm d’épaisseur en l’absence de signe clinique de rupture complète traduit une rupture partielle (16). Pour le même auteur, il n’existe pas de supériorité de l’IRM ou de l’échographie pour distinguer l’atteinte partielle de la rupture totale. Néanmoins, certains signes plaident pour une rupture complète (15, 17) :
• incarcération de la graisse périachilléenne au sein d’une zone de discontinuité tendineuse (Fig. 5) ;
• visualisation du muscle plantaire (Fig. 6) ;
• cône d’ombre postérieur en regard de la zone de rupture tendineuse ;
• présence de calcifications avec cône d’ombre postérieur au sein d’une zone hétérogène.
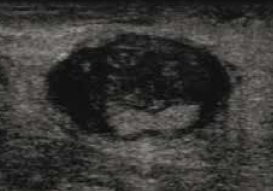
Figure 5 – Échographie. Rupture complète du tendon achilléen. Incarcération de graisse hyperéchogène au sein d’un tendon épaissi traduisant une rupture complète.
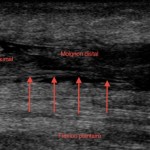
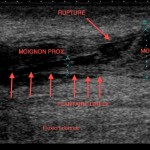
Figure 6 – Échographie. Rupture complète du tendon achilléen. Visualisation du tendon plantaire incarcéré dans la rupture avec une image de pseudo-rupture partielle.
On rappellera que la visualisation du muscle plantaire sous forme d’un tendon restant continu au sein de la rupture achilléenne ne doit pas faire porter à tort un diagnostic de rupture partielle du tendon calcanéen.
À ce jour, à notre connaissance, il n’existe pas de revue comparant la pertinence de l’échographie ou de l’IRM pour la distinction entre la rupture partielle et chronique selon des critères stricts avec confrontation chirurgicale.
Cette distinction est probablement intéressante car même si le critère clinique reste le plus important, près de 20 % des ruptures complètes pourraient être manquées lors de l’examen initial (2).
Dans l’étude d’Hartgerink avec corrélation chirurgicale et confrontation échographique sur 26 cas, la sensibilité de l’échographie était de 100 %, la spécificité de 83 % avec une pertinence de 92 % pour la distinction entre rupture complète et le groupe rupture partielle-tendinose. La valeur prédictive positive de l’examen était de 88 %. Plus important, la valeur prédictive négative était de 100 %. L’épaisseur du tendon (P < 0,001), l’existence d’un cône d’ombre postérieur et la présence d’une rétraction tendineuse (P < 0,001) étaient bien corrélées à une rupture complète. La visualisation d’une hernie graisseuse ou celle du tendon plantaire l’étaient de manière moindre (respectivement P = 0,051 et P = 0,098). Enfin, l’étude de l’échogénicité dans la zone suspecte n’était pas discriminante (15).
Brasseur rappelle lui aussi les difficultés échographiques pour distinguer la rupture partielle de l’atteinte complète :
• Le siège de la lésion est souvent comblé par des résidus fibrino-nécrotiques.
• La rupture ne comporte souvent pas de berge nette mais l’intrication de fibres rompues avec très souvent des fibres tendineuses résiduelles dilacérées et détendues.
• Enfin, toujours le tendon plantaire qui peut être individualisé et confondu avec une portion restante de tendon calcanéen (17).
En pratique, les ruptures partielles les plus fréquentes sont en fait des clivages intratendineux longitudinaux, en particulier sur le versant antérieur de l’enthèse distale ou de la jonction myotendineuse proximale (17).
• L’atteinte de la jonction myotendineuse est souvent progressive, en particulier chez le sujet âgé (Fig 7. et 8), avec un diagnostic échographique parfois difficile lié à l’interposition de matériel échogène simulant la présence d’un muscle soléaire intègre.
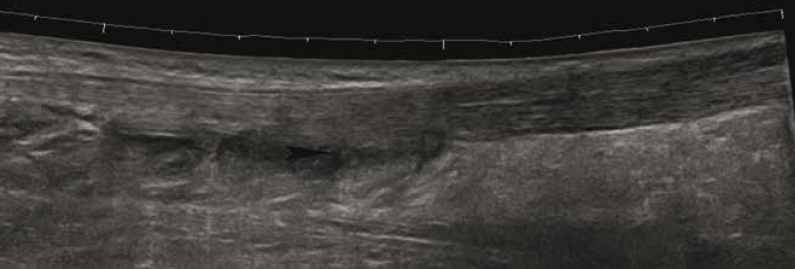
Figure 7 – Rupture partielle de la jonction myotendineuse en échographie.
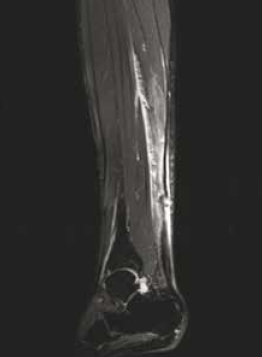
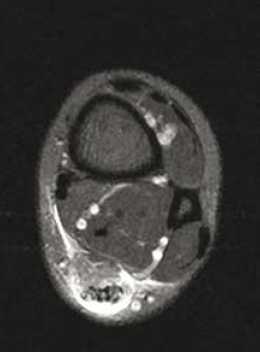
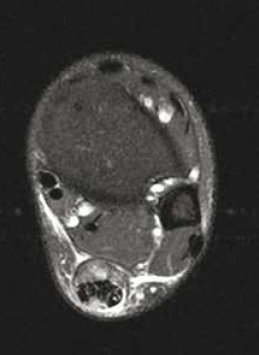
Figure 8 – IRM axial et sagittal T2fatsat. Rupture partielle de la jonction myotendineuse intéressant les fibres les plus postérieures.
Une étude sur un petit groupe de sportifs (18) a montré une incidence faible des ruptures partielles intéressant la jonction myotendineuse. Dans la mesure où aucune donnée épidémiologique n’existe sur l’incidence des ruptures intratendineuses, certains auteurs considèrent qu’une aggravation brutale de la symptomatologie clinique et l’apparition de plages hypo-échogènes intratendineuses, d’autant plus qu’il existe une lame liquidienne péritendineuse s’insinuant au sein du tendon, traduisent une rupture partielle (18) (Fig. 9 et 10).
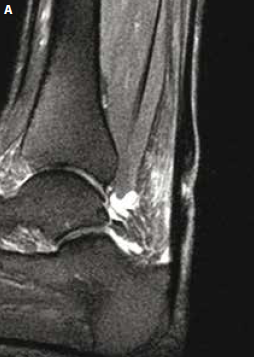
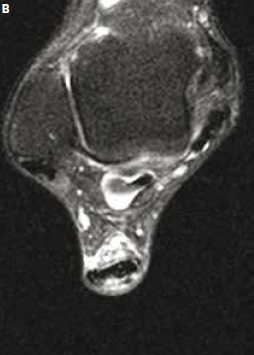
Figure 9 – IRM sagittal et axial T2fatsat. Rupture partielle des fibres postérieures du tiers moyen du tendon achilléen survenue sur tendon sain à l’occasion d’une randonnée à marche forcée. Rupture partielle des fibres postérieures avec important oedème péritendineux circonférentiel. À noter le caractère subnormal du tendon sous-jacent.
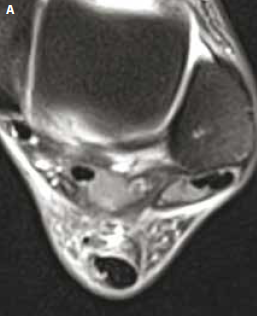
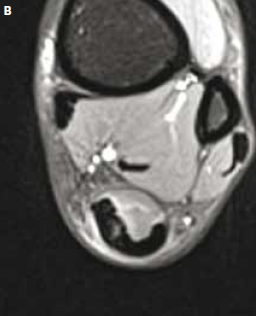
Figure 10 – IRM coupes axiales T2. Aggravation brutale pendant un marathon d’une douleur achilléenne. Rupture partielle avec hypersignal péritendineux et clivage intratendineux se poursuivant jusqu’à la jonction myotendineuse.
En revanche, le caractère épaissi du tendon ou une anomalie du péritendon isolément sont aspécifiques car retrouvés dans toutes les tendinopathies.
L’IRM est peut-être supérieure en pondération T2 pour objectiver les clivages liquidiens intratendineux. Les séquences avec injection de gadolinium semblent supérieures pour confirmer la perte de substance ou l’existence d’images pseudo-kystiques nécrotiques intratendineuses (18, 19).
Une étude radioclinique rétrospective réalisée sur 88 IRM de tendon d’Achille chez des patients symptomatiques et asymptomatiques montre des résultats assez étonnants (20). La présence d’un hypersignal intratendineux, ou un épaississement tendineux, ne traduit pas systématiquement des symptômes douloureux. De plus, l’existence d’une péritendinopathie ou d’un oedème préachilléen de la graisse de Kager a fréquemment été constatée dans le groupe asymptomatique.
L’hypersignal péritendineux est donc peu spécifique et une étude récente a montré la présence d’un hypersignal du premier et dernier tiers du péritendon chez 40 % des 100 volontaires asymptomatiques étudiés (21). L’immense majorité des ruptures constatées dans le groupe symptomatique était interstitielle (61 %) et une rupture partielle était objectivée dans 17 % des cas. Dans le groupe asymptomatique, seuls des clivages interstitiels étaient visualisés (20).
Les mêmes auteurs rappellent la difficulté de distinguer une dégénérescence mucoïde hypoxique de véritables clivages interstitiels, tous deux à l’origine d’images linéaires en hypersignal T2 intratendineux. Alors qu’un hypersignal intratendineux et l’oedème de la graisse de Kager n’étaient pas discriminants, un oedème du calcaneus et une bursite rétrocalcanéenne étaient quasi exclusivement l’apanage des patients symptomatiques (Fig. 11).
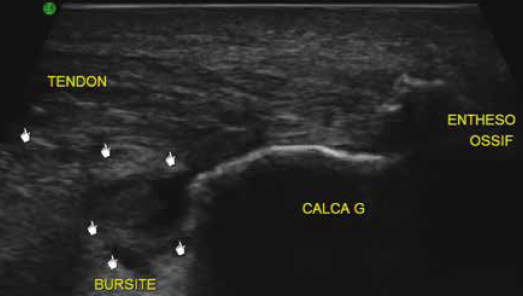
Figure 11 – Tendinopathie distale avec bursite liquidienne en échographie.
Enfin, bien qu’un épaississement tendineux soit constaté chez des patients asymptomatiques, cette étude montre une corrélation entre l’importance de l’épaississement tendineux et son caractère symptomatique (20).
Les anomalies extratendineuses, comme l’oedème préachilléen, seraient peut-être en rapport avec une variabilité de la vascularisation antérieure achilléenne.
Les séquences STIR montrent un hypersignal T2 en cas de dégénérescence mucoïde intratendineuse, mais ce signal serait encore plus élevé en présence de clivages interstitiels. Le spectre allant de la dégénérescence mucoïde aux stades de clivages interstitiels longitudinaux, ruptures partielles, et enfin ruptures complètes reste néanmoins difficile à distinguer (20).
Doppler
Les résultats sont contrastés. L’hypervascularisation Doppler se- rait corrélée au caractère symptomatique d’une tendinopathie. Les anomalies de vascularisation péritendineuse seraient corrélées à un taux plus important de rupture. Les tendinopathies sans hyperémie Doppler auraient un meilleur résultat clinique après traitement conservateur (22).
En pratique, la position en hyperflexion ou extension du tendon d’Achille modifie le dépistage de cette hypervascularisation, qui comme on le sait est plus prononcée sur la face antérieure du tendon.
Élastographie
L’élastographie (ou élastosonographie) est une modalité d’imagerie ultrasonore récente permettant d’évaluer de façon non invasive l’élasticité des tissus mous. L’élasticité tissulaire est quantifiée par une constante physique, le module d’élasticité de Young, rapport entre la déformation d’un matériau élastique et la contrainte longitudinale d’étirement qui lui a été appliquée.
L’intérêt de l’élastographie impulsionnelle est sa capacité à fournir en temps réel une cartographie couleur de l’élasticité tissulaire. La place de cet examen est encore mal définie.
Le tendon d’Achille est la structure la plus étudiée à ce jour dans les applications musculo-squelettiques de l’élastographie (23). Dans une étude sur 50 tendons d’Achille asymptomatiques et normaux chez des volontaires sains, les tendons présentaient deux types de structures en élastographie : soit homogènes dures dans la majorité des cas (62 %), soit discrètement inhomogènes avec des zones plus molles (bandes longitudinales ou taches), qui n’étaient pas visibles en mode B ou Doppler (24) (Fig. 12).
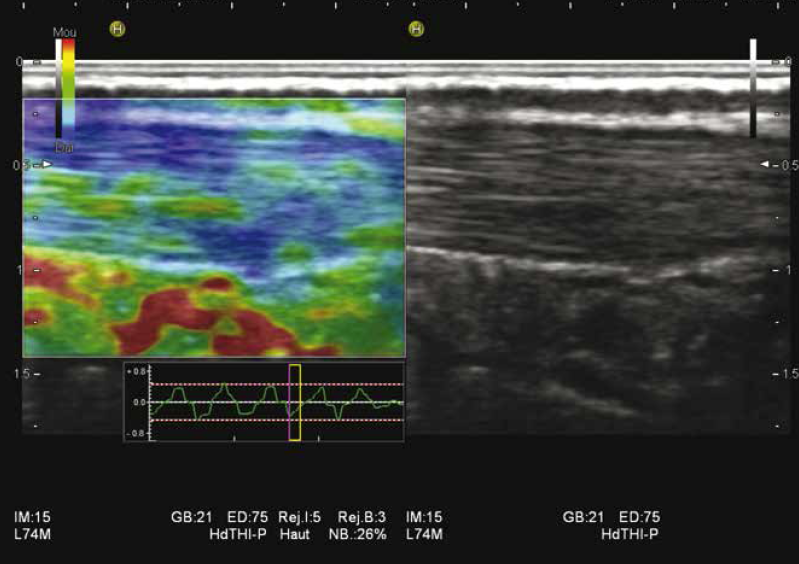
Figure 12 – Tendon d’Achille discrètement inhomogène en élastographie sans anomalie 2D.
Les tendons asymptomatiques ont été jugés homogènes et rigides dans 86 à 93 % des cas, présentant un assouplissement minime (jaune) dans 7 à 12 % des cas et contenant un assouplissement marqué (rouge)dans 0 à 1,3 % des cas seulement (25-27). En revanche, les tendons symptomatiques présentaient un assouplissement marqué dans 57 % des cas, un assouplissement minime dans 11 % des cas et une structure rigide dans 32 % des cas (25).
Les modifications dans les tendons asymptomatiques ont été principalement observées au niveau de la partie moyenne du tendon. La nature des altérations des tendons asymptomatiques avec échographie 2D normale n’est pas claire, et pourrait correspondre à des changements précoces comme à des faux positifs.
La reproductibilité pour le tendon d’Achille a été évaluée par plusieurs études. La corrélation globale entre les résultats de l’échographie et l’élastographie a été jugée excellente (précision 97 %), à condition qu’une augmentation minime (jaune) soit considérée comme physiologique et que seules les zones rouges soient considérées comme pathologiques (25-29) (Fig. 13).
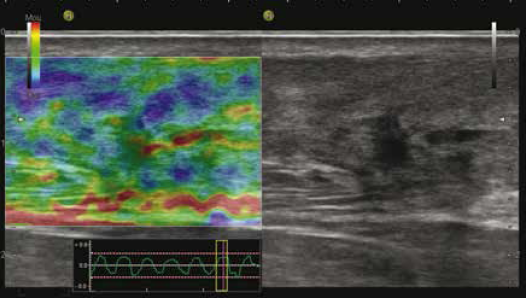
Figure 13 – Tendinose cicatricielle évoluée avec des plages rouges en élastographie.
La reproductibilité inter- et intra-observateur a été mesurée pour tendons d’Achille normaux et anormaux par deux études ; elle est jugée de bonne à excellente, si l’évaluation de l’élastogramme a été réalisée qualitativement, en utilisant le modèle de couleur prédominante (24, 29).
Cas particuliers
Ruptures chroniques
(Fig. 14, 15)
Il s’agit de ruptures aiguës du tendon calcanéen non diagnostiquées et repérées tardivement au stade séquellaire.
L’échographie comme l’IRM montrent un tendon allongé épaissi avec une perte de substance intratendineuse qui sera évaluée de manière précise.
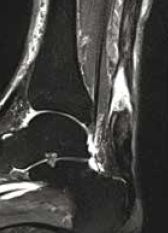
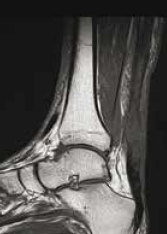
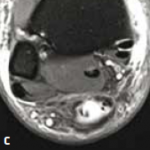
Figure 14 – Rupture chronique méconnue vue à 1 mois.
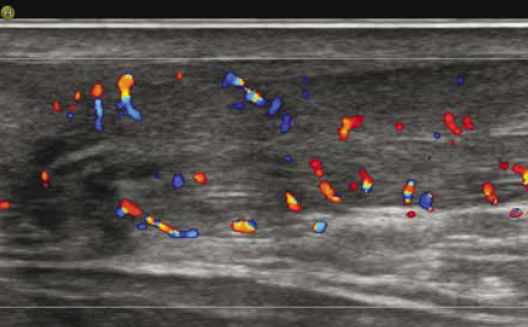
Figure 15 – Contrôle à 6 mois d’une rupture complète traitée orthopédiquement. Aspect hétérogène et hypervascularisé toujours persistant.
Récidives
On regroupe sous ce terme les ruptures itératives. Le taux de re-rupture est de :
• 10 à 15 % après traitement orthopédique par immobilisation plâtrée ;
• 4 à 10 % après chirurgie percutanée (Tenolig) ;
• inférieure à 2 % après chirurgie conventionnelle (1).
Plusieurs auteurs ont montré la difficulté d’étudier les tendons opérés qui présentent toujours une plage hypo-échogène hétérogène en regard de la zone cicatricielle qui persiste longtemps après chirurgie. L’étude Doppler montre normalement une disparition de l’hypervascularisation dans tous les cas à plus de 2 ans de la suture (4).
La présence d’une structure fibrillaire continue dans la zone de réparation tendineuse n’est pas en elle-même un critère discriminant puisqu’elle ne réapparaît que tardivement après chirurgie. Elle n’était présente que chez 29 % des patients étudiés, tous examinés à plus d’1 an dans l’étude de Miquel et al. (4) Par ailleurs, une image de clivage en hypersignal T2 liquidien intratendineux peut être observée jusqu’à 6 mois après traitement chirurgical ou orthopédique (Fig. 16).
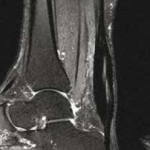
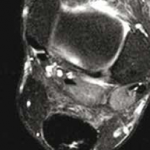
Figure 16 – IRM sagittal et axial T2fatsat. Clivage intratendineux persistant à 1 an d’une rupture achilléenne complète traitée orthopédiquement.
Un épaississement du tendon peut persister plus d’1 an après (30).
Maladie de Haglund
La maladie de Haglund est liée à une proéminence constitutionnelle du rebord postéro-supérieur du calcaneus. Cette déformation vient irriter la bourse rétrocalcanéenne et le versant antérieur de l’insertion du tendon.
L’irritation chronique va entamer progressivement le tendon, entraînant une rupture des fibres les plus antérieures du tendon calcanéen qui s’élargit, expliquant ce siège classique de rupture partielle distale du tendon achilléen (5) (Fig. 17 et 18).
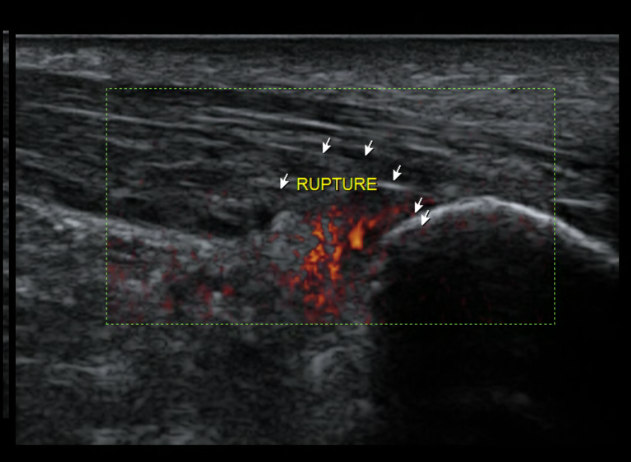
Figure 17 – Rupture partielle distale intéressant les fibres les plus antérieures.

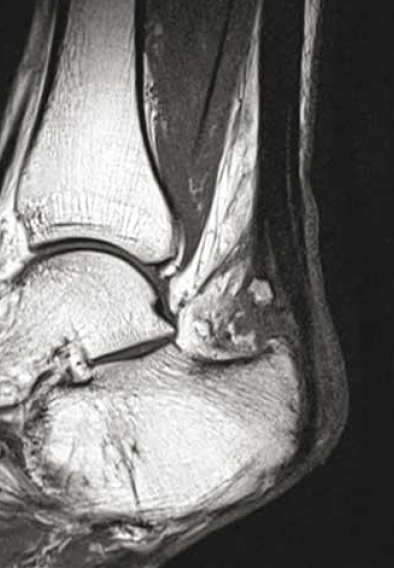
Figure 18 – IRM sagittal T1 et T2fatsat. Syndrome d’Haglund compliqué. Désinsertion partielle des fibres antérieures du tendon calcanéen.
Conclusion
Dans la mesure où le spectre des lésions tendineuses achilléennes est lié à une mise en défaut du cycle altération/réparation des fibres de collagène, on pourrait conclure de manière provocatrice, par opposition au dogme chirurgical, qu’en routine radiologique nous ne voyons que des ruptures partielles… Il n’existe pas de critère histologique ou radiologique pour différencier ces stades s’étendant de la tendinose à la prérupture complète. C’est pourquoi, en pratique, l’examen radiologique et surtout échographique sera toujours doublé d’un testing clinique pendant l’examen pour sensibiliser le dépistage des plages de clivage et démasquer d’éventuelles ruptures complètes masquées au sein d’un agrégat fibrineux cicatriciel.



