Que sait-on sur le lactate en 2020 ?
Doit-on le considérer comme un simple déchet de l’organisme ?
Le lactate est depuis de nombreuses années considéré de façon erronée comme un « déchet » du métabolisme glycolytique et sa production par le muscle en activité est tenue responsable de la survenue de l’acidose, des crampes et de la fatigue musculaire. Ainsi, le lactate est associé à la douleur musculaire et est toujours perçu comme délétère pour la performance (1). Cependant, à côté de cette vision négative du lactate, de nombreuses études ont montré que le lactate est en fait un intermédiaire métabolique particulièrement important pour les échanges d’énergie et d’information entre les cellules, les tissus et les organes (1). Le lactate est produit continuellement par le muscle dès lors que celui-ci utilise du glucose via la glycolyse. Ainsi, la lactatémie va augmenter au cours d’un exercice, même si l’apport en oxygène est satisfaisant, permettant d’amener un substrat énergétique au muscle (1). De plus, Robergs et al. (2) ont mis en évidence que la production de lactate par le muscle au cours de l’effort était non seulement nécessaire pour le fonctionnement de la glycolyse mais aussi que cette production permettait de retarder la survenue de l’acidose. Plus récemment, le lactate a été reconnu comme étant une molécule de signalisation contrôlant différents processus fondamentaux en physiologie de l’exercice.
Introduction
La production de lactate est nécessaire au maintien de la glycolyse par le muscle en activité
La production d’ATP
Lors de l’exercice musculaire, l’énergie sous forme d’adénosine triphosphate (ATP), nécessaire aux contractions musculaires, est apportée principalement par la mitochondrie grâce à l’oxydation des glucides (glycogène et glucose) et des lipides (voie aérobie).
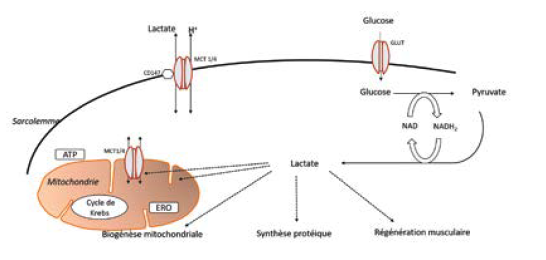
De façon concomitante, il existe une production d’ATP extra-mitochondriale via la dégradation du glycogène et du glucose qui ne nécessite pas l’utilisation d’oxygène (voie anaérobie). La dégradation du glucose (glycolyse), qui aboutit à la production de pyruvate, a besoin de NAD (nicotine-adenine-dinucléotide) pour fonctionner (Fig. 1). Si cette régénération de NAD à partir du NADH2 est insuffisamment réalisée par les mitochondries, soit parce que l’apport en oxygène est insuffisant, soit parce que le fonctionnement mitochondrial est trop lent par rapport à la demande d’énergie, la dégradation du glycogène et/ou du glucose ne peut se poursuivre que grâce au transfert du H2 du NADH2 sur l’acide pyruvique grâce à la LDH. Cela conduit à la formation de trois molécules d’ATP qui peuvent être utilisées par le muscle, mais aussi à la production de lactate.
L’acidose musculaire
Cette production d’ATP est particulièrement importante au début de l’exercice quand l’apport en oxygène aux muscles est insuffisant, et lors d’exercices intenses lorsque l’activité mitochondriale ne permet pas une régénération suffisamment rapide de NAD. Ainsi, l’augmentation de la concentration sanguine en lactate avec l’intensité de l’exercice est due à une accélération de la glycolyse, à l’incapacité de l’organisme à absorber cet excès de lactate et au recrutement progressif des fibres les plus glycolytiques (1). L’accélération de la glycolyse va toujours aboutir à une production accrue de lactate puisque l’activité de la LDH est beaucoup plus rapide que celle des enzymes de la voie oxydative (1). Comme la concentration de lactate musculaire augmente et que de façon concomitante le pH s’abaisse, cette augmentation a longtemps été considérée comme étant la cause de la survenue de l’acidose musculaire. Or, la production de lactate, même si elle est concomitante de l’acidose, n’en est pas la cause puisqu’elle consomme des ions H+ (2). La survenue de l’acidose est en fait la conséquence de la production d’ions H+ qui résulte de l’hydrolyse de l’ATP nécessaire au travail cellulaire (2).
Le lactate est un substrat énergétique
Un substrat énergétique échangeable
Le lactate ne doit pas être considéré comme un « déchet » métabolique puisque, d’un point de vue biochimique, l’oxydation d’une molécule de lactate permet la production de dix-huit molécules d’ATP, soit la moitié de la quantité produite par l’oxydation d’une molécule de glucose. D’ailleurs, il est connu depuis très longtemps qu’un muscle en activité libère du lactate dans le sang et que si la contraction se poursuit le muscle finit par recapter du lactate pour l’utiliser comme substrat énergétique (3). Le lactate est donc un substrat énergétique à part entière pour le muscle, mais c’est aussi un substrat énergétique échangeable entre les organes et les tissus.
La navette du lactate
Ainsi, dans les années 1990, G. Brooks (4) a proposé le concept de « navette du lactate » qui permet de comprendre comment le lactate produit principalement par les fibres glycolytiques de type II d’un muscle en activité peut :
1. être libéré dans la circulation pour être ensuite capté et utilisé par oxydation comme substrat énergétique par le cœur ou par d’autres muscles au repos ou en activité ;
2. être capté par des fibres musculaires oxydatives de type I situées dans le même muscle pour y être oxydé (Fig. 2).
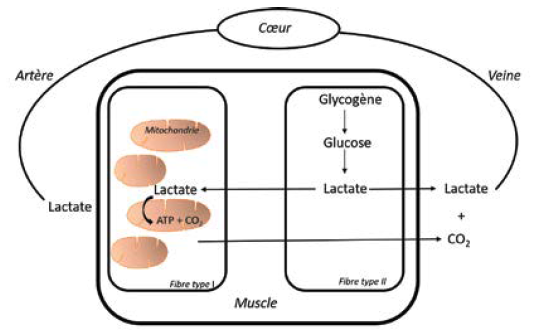
On comprendra donc facilement que le seul dosage de la lactatémie, souvent effectué en médecine du sport, ne peut pas être considéré comme un bon reflet de la production de lactate par le muscle et encore moins du métabolisme anaérobie musculaire.
Les échanges du lactate dans l’organisme
Le mécanisme de transport
Grâce aux travaux du groupe de G. Brooks, de l’Université de Berkeley, les connaissances concernant les mécanismes d’échange du lactate entre les cellules, les tissus et les organes ont considérablement évolué. Ainsi, ce groupe a pu démontrer que les échanges du lactate impliquaient un mécanisme de transport facilité du type symport lactate/proton appartenant à la famille des transporteurs des monocarboxylates (MCT) (5). Comme ce sont des symports lactate/protons, ces transporteurs jouent un rôle majeur dans la régulation du pH intracellulaire et la coordination du métabolisme (6). Au niveau du muscle squelettique, on trouve deux principales isoformes MCT1 et MCT4 qui présentent des caractéristiques bien distinctes. L’isoforme MCT1 permet le captage du lactate par le muscle pour y être oxydé, tandis que MCT4 intervient dans la libération du lactate.
Variation de la quantité des transporteurs
Il existe de nombreuses situations où la quantité de ces transporteurs peut varier, mais le principal facteur de variation est l’activité musculaire (6). Ainsi, l’entraînement en endurance augmente l’expression de ces isoformes au niveau des muscles squelettiques, mais surtout l’isoforme MCT1 (6). Ces variations d’expression de MCTs ont des répercussions sur la cinétique du lactate au niveau du corps entier et sur la vitesse d’élimination du lactate au décours d’un exercice exhaustif (7). De plus, plusieurs études ont montré qu’un polymorphisme sur le gène SLC16A1 codant pour MCT1 était associé à une meilleure performance d’endurance (8).
Le lactate pourrait perturber la contraction musculaire
Même si le lactate peut être considéré comme un substrat particulièrement utile pour le muscle en activité, il convient tout de même de considérer que certaines expérimentations suggèrent que l’accumulation du lactate pourrait perturber la contraction musculaire et cela indépendamment de la baisse du pH. En effet, Hogan et al. (9) ont montré que le lactate pouvait réduire la force musculaire développée par contraction musculaire indépendamment de la baisse du pH. Ces auteurs avaient alors suggéré que la baisse de la force musculaire était probablement liée à une altération du couplage excitation-contraction dans le muscle. Notre groupe a aussi observé (résultats non publiés), grâce à l’utilisation de la microscopie confocale, que le lactate réduisait la libération de calcium par le réticulum sarcoplasmique confirmant ainsi que le lactate pourrait bien perturber le couplage excitation-contraction.
Le lactate et les faux concepts !
Le dosage du lactate dans le sang, qui est fréquemment effectué en médecine du sport, fait très souvent l’objet de mauvaises interprétations.
Le seuil anaérobie ?
Ainsi, l’augmentation de la concentration de lactate dans le sang, généralement observée vers une intensité de l’ordre de 50 % de la puissance maximale au cours d’un exercice à charge progressivement croissante, a souvent été interprétée à tort comme étant le témoin de la mise en jeu des mécanismes énergétiques anaérobies et a conduit à la notion très répandue de « seuil an-aérobie ». En fait, cette interprétation est totalement fausse, car le lactate est produit dès le début de l’exercice et l’augmentation de la lactatémie observée vers 50 % de la puissance maximale n’est en fait que le résultat d’un déséquilibre entre production et élimination du lactate par oxydation, mais en aucun cas le témoin de la mise en jeu de mécanismes énergétiques anaérobies (1, 10).
Une production moindre chez les sportifs ?
Une deuxième notion très répandue et tout aussi erronée est que les sportifs produisent moins de lactate au cours de l’exercice que des sujets sédentaires. En fait, Donovan et Brooks (11) ont depuis longtemps clairement montré, en utilisant des traceurs radioactifs chez l’animal, que les concentrations moins élevées de lactate dans le sang observées après entraînement n’étaient pas dues à une production moins importante de lactate, mais à une élimination plus rapide du lactate.
Les nouveaux rôles identifiés du lactate
Depuis quelques années, un nouveau rôle de molécule de signalisation a été clairement démontré pour le lactate. Le lactate est ainsi actuellement considéré comme une « lactormone » (12). En effet, de nombreux travaux ont montré que le lactate pouvait activer de nombreuses voies de signalisation impliquées :
• dans la biogenèse mitochondriale (1),
• dans l’hypertrophie musculaire (13),
• dans la régénération musculaire (13)
• et dans la production de radicaux libres (6).
Le lactate peut aussi moduler et interagir avec le système immunitaire, soulignant les interconnexions importantes entre la régulation du métabolisme et de l’immunité (14) et faisant de cette molécule une cible thérapeutique de choix en cancérologie .
Conclusion
Ainsi, comme l’a écrit L. Gladden (15), « Il n’est donc plus concevable de considérer le lactate comme le suspect d’un crime métabolique, mais au contraire il faut le considérer comme un acteur essentiel du métabolisme à l’échelle cellulaire, tissulaire et de l’organisme. Le lactate est un intermédiaire important dans de nombreux processus métaboliques et il est un substrat particulièrement mobile pour le métabolisme aérobie ».
En conclusion, le lactate ne doit pas être considéré comme un produit de fin de métabolisme, mais plutôt comme un intermédiaire métabolique permettant les échanges d’énergie dans l’organisme et comme une molécule de signalisation à laquelle de nouveaux rôles ont récemment été attribués. Sa production pendant l’exercice permet le maintien de la dégradation du glucose par la glycolyse. Elle retarde, mais ne cause par l’acidose. La mesure de la concentration de lactate dans le sang doit être interprétée avec prudence afin de pas conduire à des interprétations erronées sur le plan métabolique.
Bibliographie
1. Ferguson BS, Rogatzki MJ, Goodwin ML et al. Lactate metabolism: historical context, prior misinterpretations, and current understanding. Eur J Appl Physiol 2018 ; 118 : 691-728.
2. Robergs R, Ghiasvand F, Parker D. Biochemistry of exercise-induced metabolic acidosis. Am J Physiol Regul Integr Comp Physiol 2004 ; 287 : R502-16.
3. Welch H, Stainsby W. Oxygen debt in contracting dog skeletal muscle in situ. Respir Physiol 1967 ; 3 : 229-42.
4. Brooks G. Current concepts in lactate exchange. Med Sci Sports Exerc 1991 ; 23 : 895-906.
5. Roth D, Brooks G. Lactate and pyruvate transport is dominated by a pH gradient-sensitive carrier in rat skeletal muscle sarcolemmal vesicles. Arch Biochem Biophys 1990 ; 279 : 386-94.
6. Thomas C, Bishop DJ, Lambert K et al. Effects of acute and chronic exercise on sarcolemmal MCT1 and MCT4 contents in human skeletal muscles: current status. Am J Physiol Regul Integr Comp Physiol 2012 ; 302 : R1-14.
7. Thomas C, Perrey S, Lambert K et al. Monocarboxylate transporters, blood lactate removal after supramaximal exercise and fatigue indexes in humans. J Appl Physiol 2005 ; 98 : 804-9.
8. Fedotovskaya ON, Mustafina LJ, Popov DV et al. A common polymorphism of the MCT1 gene and athletic performance. Int J Sports Physiol Perform 2014 ; 9 : 173-80.
9. Hogan M, Gladden L, Kudak S, Poole D. Increased (lactate) in working dog muscle reduces tension development independent of pH. Med Sci Sports Exerc 1995 ; 27 : 371-7.
10. Stanley W, Gertz E, Wisneski J et al. Systemic lactate kinetic during graded exercise in man. Am J Physiol 1985 ; 249 : E595-602.
11. Donovan C and Brooks G. Endurance training affects lactate exchange, not lactate production. Am J Physiol 1983 ; 244 : E83-92.
12. San-Millán I and Brooks GA. Reexamining cancer metabolism: lactate production for carcinogenesis could be the purpose and explanation of the Warburg Effect. Carcinogenesis 2017 ; 38 ; 119-33.
13. Tsukamoto S, Shibasaki A, Naka A et al. Lactate promotes myoblast differentiation and myotube hypertrophy via a pathway involving myoD in vitro and enhances muscle regeneration in vivo. Int J Mol Sci 2018 ; 19 : 1-14.
14. Breuker C, Amouzou C, Fabre O et al. Decreased RNF41 expression leads to insulin resistance in skeletal muscle of obese women. Metabolism 2018 ; 83 : 81-91.
15. Gladden L. Lactate metabolism: a new paradigm for the third millennium. J Physiol 2004 ; 558 : 5-30.


