La périostite : une lésion fréquente chez le coureur à pied
Introduction
La périostite, dénommée médial tibial stress syndrome par les Anglo-Saxons, est une lésion fréquente chez le coureur à pied, responsable d’une douleur du bord postéro-médial du tibia. Elle représente 13 à 35 % des lésions répertoriées dans la pratique de ce sport selon les auteurs, et cette fréquence importante ne doit pas occulter les délais de retour sur le terrain qui peuvent être très longs, jusqu’à 30 mois (1-3).
De plus, une première lésion expose à des récidives sur la même jambe ou l’autre de façon extrêmement fréquente : le surrisque est de 20 à 32 fois par rapport aux témoins sans antécédent de périostite (4, 5).
Physiopathologie
Celle-ci reste débattue.
Une hyper-sollicitation du périoste ?
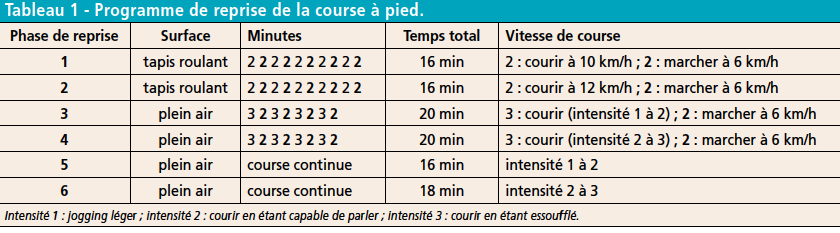
Pour certains, il s’agit d’une hyper-sollicitation de la membrane entourant la corticale osseuse : le périoste. Cette hyper-sollicitation serait due en particulier à la traction des muscles postérieurs du mollet, et en premier lieu des muscles de la loge profonde (tibial postérieur, long fléchisseur des orteils, long fléchisseur de l’hallux) et du fascia crural profond (2, 6). Ce mécanisme serait responsable d’une « hyper-ostéoblastose » localisée de la corticale du tibia. Les tractions musculaires répétées par des muscles « fatigués », donc plus raides, seraient responsables de micro-fractures dans la zone la plus incurvée du tibia. Les délais de récupération trop courts, liés à la répétition des entraînements et des courses favoriseraient donc ces lésions, dont la pathogénie rappelle celle des fractures de contrainte (2) (Fig. 1).
Un remaniement cortical ?
Pour d’autres, ce sont les efforts en flexion compression du tibia dans la zone incurvée du tibia qui seraient responsables d’un remaniement cortical (7).
La déminéralisation locale de la corticale est d’ailleurs visible en absorptiométrie jusqu’à 8 ans après les symptômes (7).
Diagnostic et pronostic
L’examen clinique
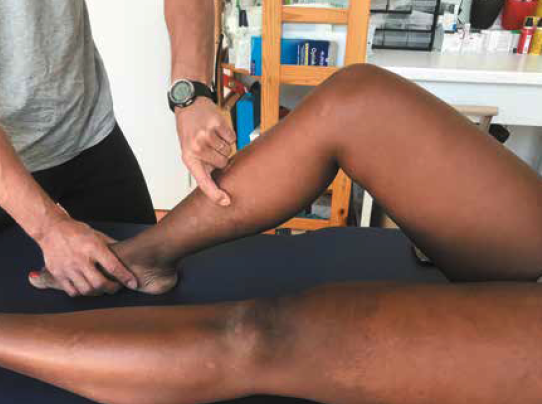
Poser le diagnostic est simple. Une histoire d’intensification de l’entraînement en course à pied et de compétitions rapprochées est souvent retrouvée. La douleur se localise sur le bord postéro-médial du tibia, sur une distance d’au moins 5 cm, et est souvent bilatérale (50 % des cas). Elle est déclenchée par une palpation appuyée avec les doigts en crochets (Fig. 2). Une tuméfaction locale ou une sensation de chaleur locale peut être retrouvée (8) (Fig. 3).

L’imagerie
La radiographie
Les radiographies sont normales. Elles ont principalement pour vertu d’éliminer un diagnostic différentiel.
L’échographie
L’échographie est peu spécifique, mais peut retrouver une zone hypo-échogène en regard du périoste atteint et une hyper-vascularisation locale en mode Doppler puissance.
La scintigraphie osseuse
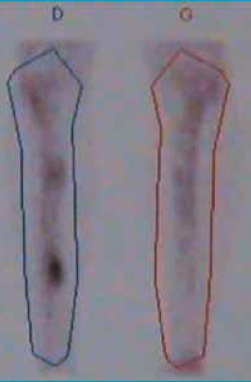
La scintigraphie osseuse au technétium 99 retrouve une fixation uniquement au temps tardif de l’examen, sur une longueur importante (Fig. 4).
L’IRM
L’IRM est l’examen de choix, et montre un œdème médullaire et périosté, marqueur du remodelage osseux. Il convient toutefois de toujours corréler l’examen clinique à l’imagerie, car ces anomalies peuvent être retrouvées chez des sujets asymptomatiques (9-11) (Fig. 5).
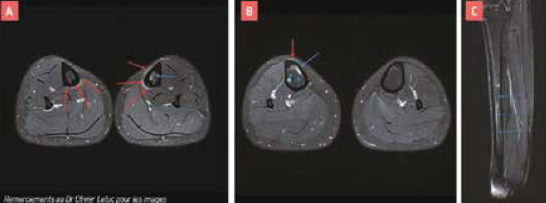
Classification
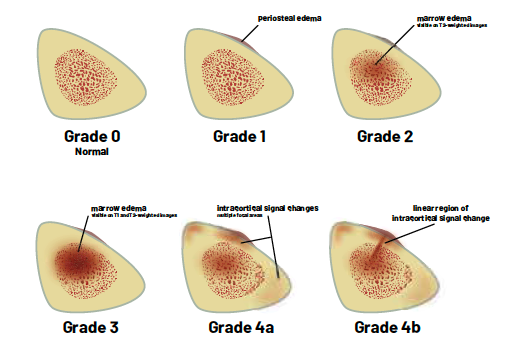
La classification de Fredericsson, reprise par Moen, apporte des éléments en termes de durée de récupération (3, 9) (Fig. 6).
• Le grade 1 retrouve un œdème périosté isolé.
• Le grade 2 retrouve un œdème médullaire surajouté, visible uniquement sur les séquences T2.
• Le grade 3 retrouve l’œdème médullaire en T1 et en T2.
• Le grade 4 retrouve des signes intra-corticaux, sous forme de plusieurs spots (grade 4a) ou de lésion fissuraire nette (grade 4b), telle qu’on les observe dans les fractures de contrainte.
Pronostic
Un œdème osseux absent est de mauvais pronostic. Pour Moen, la guérison est en moyenne de 52 jours (avec un écart type de 44 jours) si celui-ci est présent, alors qu’il est en moyenne de 79 jours (avec un écart type de 47 jours) si celui-ci est absent.
Un œdème périosté absent est aussi de mauvais pronostic.
Pour Moen, la guérison est en moyenne de 44 jours (avec un écart type de 17 jours) si celui-ci est présent, alors qu’il est en moyenne de 78 jours (avec un écart type de 52 jours) si celui-ci est absent.
Diagnostic différentiel
Tumeur osseuse
Une tumeur osseuse, dont la douleur peut n’être que mécanique au début, doit toujours être évoquée. La radiographie permet de les dépister dans la majorité des cas.
Syndrome de loge
Un syndrome de loge peut être évoqué à l’interrogatoire et confirmé par la normalité de l’examen clinique.
Téno-synovite
Une téno-synovite du tendon tibial antérieur peut donner des douleurs dans un territoire proche, mais la palpation soigneuse redresse facilement le diagnostic.
Fracture de contrainte
La principale difficulté consiste à éliminer une fracture de contrainte, qui peut succéder ou cohabiter avec une périostite. La douleur est alors exquise sur un point assez précis, éventuellement entouré d’un halo de douleur plus diffuse. Ce halo de douleur est particulièrement sensible lors du Fulcrum test, qui consiste à appliquer un diapason sur la zone sensible, ce qui aggrave localement la douleur (Fig. 7).
Facteurs de prédisposition et évaluation
Les facteurs de prédisposition
Ils sont très nombreux et ne seront pas tous cités ici. Toutefois, on peut les regrouper en grandes familles (1, 2, 4, 5, 8, 10-15).
Les facteurs intrinsèques
• Une course en rotation externe, essentiellement due à une rotation externe de hanche exagérée.
• Une hyperpronation dynamique du pied.
• Un poids du coureur élevé (facteur plus important que l’indice de masse corporelle).
• Le genre (les femmes ont un risque relatif double à quadruple).
• L’antécédent de périostite (le risque relatif est multiplié par 18 à 32).
• Un tour de mollet minime.
• L’abduction du pied lors de la propulsion.
• Le manque de stabilisation du bassin par défaut des abducteurs de hanche.
• Un pied plat valgus.
• La mise en évidence d’un signe du godet lors d’une palpation appuyée de 5 secondes (l’empreinte du doigt tarde à s’effacer) (10) (Fig. 8).
Les facteurs extrinsèques
• Le nombre d’années de pratique de la course à pied.
• Un changement d’intensité d’entraînement, avec en particulier une augmentation nette de la charge (plus de 15 % par semaine).
• Une absence d’étirements.
Les facteurs environnementaux
• Une course sur asphalte ou sur route bombée.
• Une chaussure inadaptée : mauvais serrage, coque talonnière trop large, semelle inadaptée à la surface.
Évaluation
Hyperpronation dynamique du pied
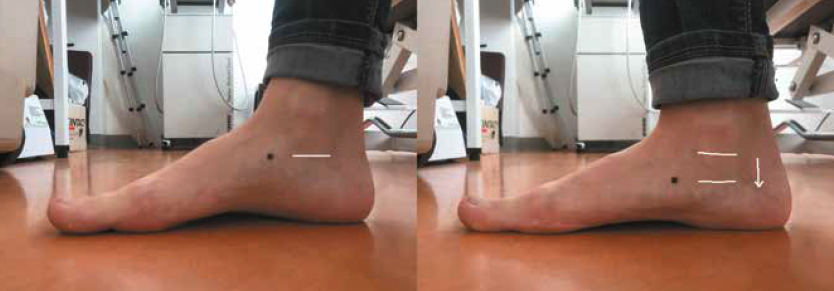
Évaluer une hyperpronation dynamique du pied n’est pas réservé aux podologues. Le Navicular drop test répond facilement à cette problématique. Il convient de repérer au feutre le tubercule de l’os naviculaire et de mesurer sa distance au sol sur un pied posé sans appui, puis de renouveler la mesure sur un pied en appui monopodal. L’affaissement normal est de 6 à 8 mm ; il est excessif au-delà de 10 à 15 mm (10, 11) (Fig. 9).
Rotation externe de hanche exagérée
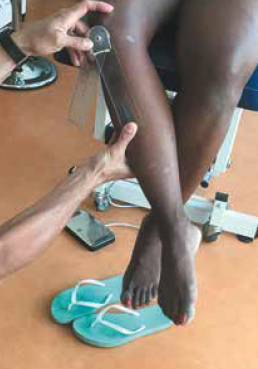
Évaluer une rotation externe de hanche exagérée peut se faire aisément en position assise avec un goniomètre, ou mieux un inclinomètre. Toutefois, La fiabilité inter-observateur (0,71) est relativement faible en position assise. Un angle de plus de 47° est considéré comme élevé et favorisant les périostites, mesuré dans cette position. La mesure en position allongée en pro-cubitus est plus fiable, mais aucune valeur limite n’a été publiée à ce jour (10) (Fig. 10).
Traitement
Le repos
Le repos sportif est essentiel. Les activités physiques en décharge (natation) ou ne reproduisant pas les impacts de la course à pied (vélo, stepper, vélo elliptique) peuvent toutefois être maintenues. Ce repos devra être prolongé durant 15 à 60 jours, mais parfois nettement plus longtemps (11-13).
Le glaçage, l’iontophorèse, la phonophorèse, l’électrothérapie
Le glaçage peut apporter un soulagement, de même que l’iontophorèse, la phonophorèse, l’électrothérapie seule ou les ultrasons selon une étude contrôlée, sans que l’une des techniques citées soit supérieure aux autres (14).
La reprise progressive de la course
La reprise très progressive de la course est une solution qui semble efficace. Un seul protocole a été convenablement décrit dans la littérature. Il fait appel à une réhabilitation en six étapes avec trois entraînements par semaine. Une étape est terminée quand l’ensemble de la phase est réalisé sans douleur (Tab. 1).
Les chaussettes compressives et manchons de compression
Les chaussettes compressives ne semblent pas apporter de bénéfice supplémentaire dans la réalisation de ce protocole (14), pas plus que les manchons de compression (lower leg brace) ou les attelles pneumatiques longues (15, 16).
Autres traitements
Divers autres traitements ont été testés contre placebo et n’ont pas non plus montré d’efficacité.
• Application de Laser basse énergie à une longueur d’onde de 810 nm et avec une énergie délivrée de 2,4 J/cm le long du tibia dans la zone sensible (six séances) (17).
• L’insertion d’aiguilles d’acupuncture au contact du périoste sensible (quatre sessions de traitement) (18).
• L’utilisation de semelles orthopédiques dans le but de limiter la pronation serait logique. En effet, une étude récente a montré une tendance pronatrice plus marquée chez les coureurs à pied, visible uniquement à la marche et non en statique (19). Toutefois, aucune étude n’a mis en évidence l’efficacité des semelles orthopédiques dans cette pathologie.
Les ondes de choc
Les ondes de choc ont en revanche montré leur efficacité dans des études non contrôlées.
Les ondes de choc radiales
Pour les ondes de choc radiales (trois sessions, 2 000 coups/session, 8 Hz, 2,5 bars), une étude a montré la supériorité associée à un programme de rééducation en 12 semaines versus le programme de rééducation seul (19).
Les ondes de choc focales
Les ondes de choc focales ont elles aussi montré une efficacité dans une étude non contrôlée associée à un programme de rééducation versus le programme de rééducation isolé, avec un protocole de cinq séances à 1 semaine d’intervalle (les trois premières) puis 14 jours (pour la quatrième) et 1 mois (pour la cinquième). L’énergie était augmentée à chaque séance, en partant de 0,10 mJ/mm² pour arriver à 0,30 mJ/mm² sur des séances de 1 500 coups (14).
Des études randomisées contrôlées ont aussi été réalisées. L’une a montré un résultat très positif avec des ondes de choc focales réalisées en une seule séance à 0,20 mJ/mm² et 1 500 impulsions (19), l’autre a montré un résultat équivalent au placebo avec cinq séances d’ondes de choc focales en augmentant l’énergie délivrée de 0,10 à 0,30 mJ en cinq séances de 1 500 impulsions (20).
Toutefois, il faut avoir en tête des temps de guérison très longs. Avec le protocole de retour sur le terrain proposé ci-dessus, il faut attendre 250 à 300 jours pour que 90 % des individus puissent courir 18 minutes sans douleur (ce qui est un faible temps de course pour un sujet passionné).
Les temps avant guérison sont extrêmement variables selon les études et ne sont pas comparables entre eux, car les critères utilisés sont souvent très différents.
Rééducation
En termes de rééducation, en l’absence de programme validé, nous proposons l’approche suivante.
En fonction du profil de coureurs
Il est souvent possible de distinguer deux profils de coureurs.
Les coureurs attaquant la foulée par le talon avec une grande amplitude
Dans ce cas, ce sont les vibrations et l’impact au sol qui pourraient être nocifs pour le périoste.
Le traitement proposé :
• éviter les sports à impact et les sauts en phase aiguë,
• puis travailler sur la foulée avec un passage sur le médio-pied,
• augmenter la cadence de course (tendre vers 180 pas/min),
• diminuer l’oscillation verticale
• et proposer un programme de course progressif en respectant la quantification du stress mécanique tel que décrit ci-dessus.
Les coureurs qui ont plutôt une attaque avant pied ou un affaissement de l’arche plantaire médiale
Dans ce cas, ce sont les tractions musculaires qui pourraient être nocives pour le périoste.
Le traitement proposé :
• relâchement de la loge postérieure (trigger point à traiter, massage du tibial postérieur),
• renforcement des muscles intrinsèques du pied et des stabilisateurs de hanche (surtout en cas d’affaissement médial marqué),
• puis renforcement excentrique du muscle tibial postérieur,
• et programme de course progressif.
Périostites aiguës versus chroniques
On distinguera également les périostites aiguës pour lesquelles le but va être de diminuer d’emblée les contraintes appliquées sur le périoste, et les périostites chroniques pour lesquelles le but va être de chercher à créer des adaptations en appliquant des contraintes progressives et dosées (parallèle tendinite aiguë/tendinopathie chronique).
La douleur
Lors de la reprise de la pratique, on acceptera une légère douleur en cas de périostite : EVA douleur inférieure à 4/10 pendant la course et pas d’augmentation des douleurs dans les 24 heures qui suivent la séance. Contrairement à une fracture de stress où l’on n’acceptera aucune douleur.
En cas d’échec des traitements médicaux
Une fasciotomie chirurgicale peut être proposée. Une seule étude a été retrouvée sur le sujet avec des résultats très moyens sur un suivi de 78 patients sur 30 mois :
• 35 % de patients guéris,
• 34 % de bons résultats,
• 22 % de résultats moyens
• et 9 % d’échecs.
Il faut noter que 41 % des sportifs opérés ont arrêté leur sport (2).
Conclusion
Ce syndrome douloureux est fréquent et peut mettre très longtemps à guérir, handicapant sérieusement les coureurs à pied.
Le diagnostic est avant tout clinique. Les traitements les plus validés à ce jour dans le traitement sont le repos avec reprise de la course très progressive, et les ondes de choc.
Bibliographie
1. Cil1. Plisky MS, Rauh MJ, Heiderscheit B et al. Medial tibial stress syndrome in high school cross-country runners: incidence and risk factors. J Orthop Sports Phys Ther 2007 ; 37 : 40‑7.
2. Yates B, White S. The incidence and risk factors in the development of medial tibial stress syndrome among naval recruits. Am J Sports Med 2004 ; 32 : 772‑80.
3. Moen MH, Schmikli SL, Weir A et al. A prospective study on MRI findings and prognostic factors in athletes with MTSS. Scand J Med Sci Sports 2014 ; 24 : 204‑10.
4. Reinking MF, Austin TM, Richter RR, Krieger MM. Medial tibial stress syndrome in active individuals: a systematic review and meta-analysis of risk factors. Sports Health 2017 ; 9 : 252‑61.
5. Hubbard TJ, Carpenter EM, Cordova ML. Contributing factors to medial tibial stress syndrome: a prospective investigation. Med Sci Sports Exerc 2009 ; 41 : 490‑6.
6. Stickley CD, Hetzler RK, Kimura IF, Lozanoff S. Crural fascia and muscle origins related to medial tibial stress syndrome symptom location. Med Sci Sports Exerc 2009 ; 41 : 1991‑6.
7. Magnusson HI, Ahlborg HG, Karlsson C et al. Low regional tibial bone density in athletes with medial tibial stress syndrome normalizes after recovery from symptoms. Am J Sports Med 2003 ; 31 : 596‑600.
8. Bennett JE, Reinking MF, Pluemer B et al. Factors contributing to the development of medial tibial stress syndrome in high school runners. J Orthop Sports Phys Ther 2001 ; 31 : 504‑10.
9. Fredericson M, Bergman AG, Hoffman KL, Dillingham MS. Tibial stress reaction in runners. Correlation of clinical symptoms and scintigraphy with a new magnetic resonance imaging grading system. Am J Sports Med 1995 ; 23 : 472‑81.
10. Garnock C, Witchalls J, Newman P. Predicting individual risk for medial tibial stress syndrome in navy recruits. J Sci Med Sport 2018 ; 21 : 586‑90.
11. Moen MH, Tol JL, Weir A et al. Medial tibial stress syndrome: a critical review. Sports Med Auckl NZ. 2009 ; 39 : 523‑46.
12. Kortebein PM, Kaufman KR, Basford JR, Stuart MJ. Medial tibial stress syndrome. Med Sci Sports Exerc 2000 ; 32 : S27-33.
13. Couture CJ, Karlson KA. Tibial stress injuries: decisive diagnosis and treatment of « shin splints ». Phys Sportsmed 2002 ; 30 : 29‑36.
14. Moen MH, Holtslag L, Bakker E et al. The treatment of medial tibial stress syndrome in athletes; a randomized clinical trial. Sports Med Arthrosc Rehabil Ther Technol SMARTT 2012 ; 4 : 12.
15. Moen MH, Bongers T, Bakker EWP et al. The additional value of a pneumatic leg brace in the treatment of recruits with medial tibial stress syndrome; a randomized study. J R Army Med Corps 2010 ; 156 : 236‑40.
16. Johnston E, Flynn T, Bean M et al. A randomized controlled trial of a leg orthosis versus traditional treatment for soldiers with shin splints: a pilot study. Mil Med 2006 ; 171 : 40‑4.
17. Nissen LR, Astvad K, Madsen L. [Low-energy laser therapy in medial tibial stress syndrome]. Ugeskr Laeger 1994 ; 156 : 7329‑31.
18. The relative effectiveness of periosteal pecking combined with therapeutic ultrasound compared to therapeutic ultrasound in the treatment of medial tibial stress syndrome type II | DUT Open Scholar [Internet]. [cité 10 juin 2019]. Disponible sur: http://openscholar.dut.ac.za/handle/10321/166.
19. Kinoshita K, Okada K, Saito I et al. Alignment of the rearfoot and foot pressure patterns of individuals with medial tibial stress syndrome: A cross-sectional study. Phys Ther Sport 2019 ; 38 : 132‑8.
20. Newman P, Waddington G, Adams R. Shockwave treatment for medial tibial stress syndrome: A randomized double blind sham-controlled pilot trial. J Sci Med Sport 2017 ; 20 : 220‑4.