Les pathologies du thorax – Partie 1
Lorsqu’on évoque les douleurs du thorax, les pathologies cardiovasculaires ou pulmonaires sont au premier plan. Une fois ces hypothèses écartées, on constate qu’il existe un certain nombre de pathologies, qu’il faut savoir analyser et correctement classifier pour permettre une thérapeutique adaptée. Si les fractures de fatigue de côtes viennent au premier plan chez le sportif, d’autres syndromes moins fréquents méritent d’être connus et reconnus.
1/ La cage thoracique
Anatomie de la cage thoracique
Constitution
La cage thoracique stricto sensu est limitée en arrière par la colonne vertébrale, les 12 paires de côtes constituant le gril costal et le sternum en avant. Sa partie supérieure est complétée par les clavicules et les omoplates. Sa partie inférieure est fermée par le diaphragme (Fig. 1).
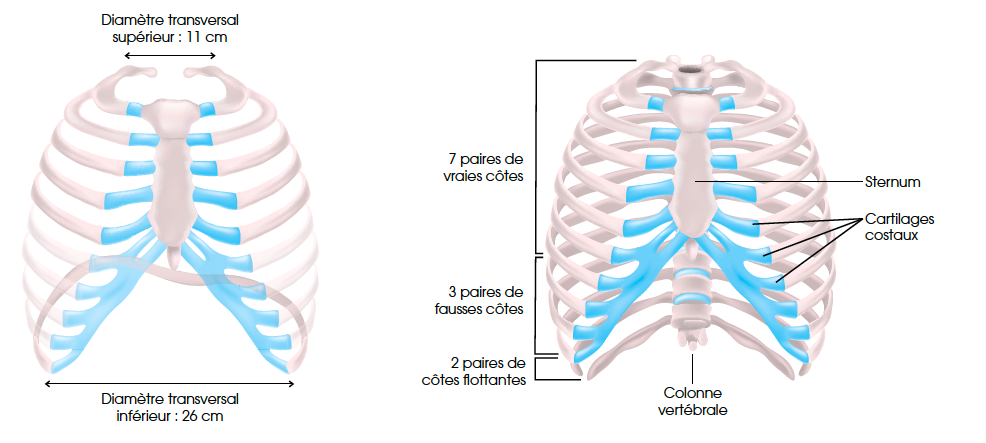
De par son rôle actif dans la mécanique ventilatoire, la cage thoracique est, par extension, également constituée de la paroi abdominale. Les côtes sont reliées à la colonne vertébrale par les articulations et les ligaments costo-vertébraux et au sternum, par des cartilages costaux.
Les contraintes mécaniques
Des études anatomiques, cadavériques montrent que la première et la septième côtes sont les plus déformables. Les contraintes mécaniques les plus grandes sont situées entre l’angle et le tubercule de la côte. La côte présente une partie rigide près de la colonne vertébrale et une partie antérieure plus déformable. La zone proche de l’angle qui assure la connexion entre ces deux régions est une zone critique. Avec le temps, on note une perte d’élasticité qui survient par ossification des cartilages costaux, ceux-ci en vieillissant s’ossifient et majorent les contraintes sur la côte du sportif.
Les déplacements des côtes et les déformations de la cage thoracique
Les côtes sont inclinées de haut en bas et d’arrière en avant. Cette inclinaison augmente graduellement de la première à la douzième. Elles se déplacent autour d’un axe défini par leur articulation avec les corps vertébraux et les apophyses transverses.
Un déplacement des côtes vers le haut entraîne une augmentation des diamètres antéro-postérieur et transversal du gril costal. Inversement, un abaissement des côtes entraîne une diminution des diamètres antéro-postérieur et transversal du gril costal.
Lors d’une augmentation de volume de la cage thoracique, les muscles élévateurs sont inspiratoires. À l’inverse, les muscles ayant tendance à se raccourcir lors d’une diminution de volume de la cage thoracique sont expiratoires. Les déformations de la cage thoracique lors de ces mouvements sont variables en fonction de la localisation. Le gril costal est peu déformable. En revanche, le diaphragme et la paroi abdominale, étant des structures essentiellement musculaires, sont facilement déformables. Le contenu de l’abdomen est incompressible. De fait, toute variation de pression intra-abdominale se répercute directement sur les parties mobiles de la cage thoracique. Ainsi, la contraction du diaphragme pendant l’inspiration entraîne une protrusion vers l’avant de la paroi abdominale. De même, lors d’une expiration forcée, la contraction des muscles abdominaux a pour but une élévation du diaphragme et une augmentation de la pression intra-thoracique.
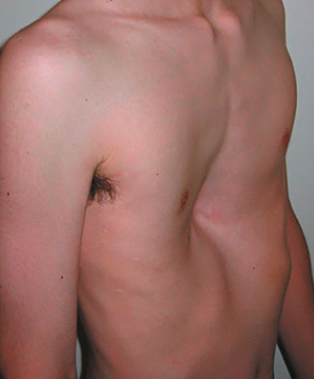
Thorax en entonnoir, thorax en carène
Les déformations du thorax sont relativement fréquentes (environ 1/400 naissances). Le thorax en carène (Fig. 2) est plus rare que le thorax en entonnoir (Fig. 3) et représente environ 20 % du total des déformations thoraciques. Quatre patients sur cinq sont de sexe masculin. Dans 25 % des cas, d’autres cas similaires sont retrouvés dans la famille.

Les causes
Les déformations congénitales de la paroi thoracique sont liées à un problème lors de la croissance de la paroi thoracique en relation avec une croissance excessive ou insuffisante (dysplasie ou aplasie) des structures osseuses ou cartilagineuses de la cage thoracique. Ces déformations sont associées, dans 95 % des cas, à une croissance excessive qui peut mener à une dépression (thorax en entonnoir) ou une protubérance du sternum (thorax en carène) ou Pectus carinatum. Le thorax en entonnoir, Pectus excavatum, est souvent présent chez les Marfan. En dehors des problèmes esthétiques majeurs, ces déformations peuvent être à l’origine de symptômes cardiorespiratoires.
Les traitements
La correction des déformations en carène du thorax est accessible à un traitement orthopédique. Ce traitement est moins risqué que le traitement chirurgical et peut donc être proposé en cas de gêne esthétique. Il s’agit toutefois d’un traitement long et contraignant. Il doit donc être clairement expliqué au patient et à sa famille afin de recueillir l’adhésion et la motivation nécessaires à sa réussite. La prise en charge du thorax en entonnoir a évolué ces dernières années avec l’apparition de la technique minimale invasive.
2/ La fracture de fatigue des côtes
Anatomie des côtes
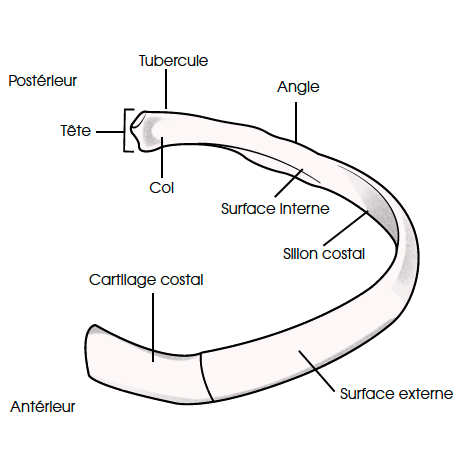
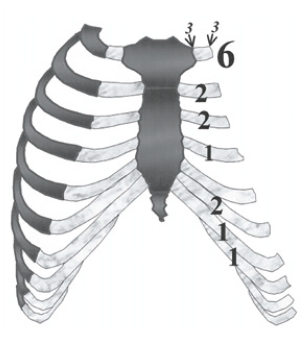
Les côtes sont des os plats, longs, incurvés. Elles vont par paires et sont asymétriques. Elles délimitent en arrière et latéralement le thorax. Elles s’articulent en arrière avec la colonne vertébrale, elles se prolongent en avant par un cartilage costal. On compte 12 côtes dont la longueur augmente de la première à la septième, puis secondairement, à partir de la huitième, leur taille diminue. Chaque côte présente d’arrière en avant trois parties : une tête, un col, un corps (Fig. 4).
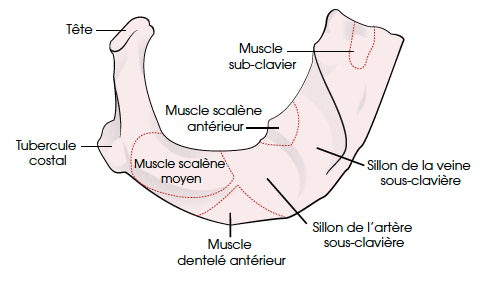
La première côte
Elle est particulière, c’est la plus petite et la plus courte des côtes (Fig. 5). Elle est aplatie de haut en bas. Elle ne présente pas de gouttière costale, mais deux gouttières situées de part et d’autre du tubercule du muscle scalène antérieur, dit de Lisfranc, pour le passage de la veine sub-clavière en avant et de l’artère sub-clavière en arrière.
La deuxième côte
Elle est deux fois plus longue que la première côte. Il existe une insertion du scalène postérieur sur la face externe de celle-ci. Elle présente sur sa partie moyenne une particularité le tubercule du dentelé antérieur.
Les onzième et douzième côtes
Les onzième et douzième côtes ne possèdent aucune tubérosité. Elles n’ont qu’une seule surface articulaire qui s’articule avec des vertèbres thoraciques 11 et 12 (Fig. 6).

Épidémiologie
Les sports à risque
La plupart des sports nécessitant un travail important des membres supérieurs sont touchés par les fractures de fatigue de côte (FFC). On peut citer en premier lieu l’aviron, mais aussi le golf, les sports de raquette, dont le tennis, les sports nécessitant des charges importantes comme la musculation ou l’haltérophilie, les skieurs de fond… Certains sports sont particulièrement ciblés et ont été largement étudiés.
Cas de l’aviron
Chez les pratiquants d’aviron, les fractures de côte, qu’il s’agisse d’une souffrance localisée ou d’une véritable fracture, représentent environ 10 % des lésions. Elles sont bien sûr plus fréquentes dans le haut niveau et chez les sportifs adultes. Dans 86 % des cas, elles touchent les côtes de la quatrième à la huitième et dans aucun cas les côtes flottantes, très rarement la première côte. Il n’y a pas de prévalence évidente entre les athlètes masculins ou féminines. Sur un plan technique, il ne semble pas exister de différence notable entre le balayage ou la godille ; pas non plus de différence en fonction des classes de poids.
Cas du golf
Une étude récente de la bibliographie a abouti à 164 articles, dont 13 répondaient à l’inclusion, et a signalé 44 cas de FFC liées au golf. Sept sites de blessures anatomiques ont été identifiés, la fracture de fatigue des côtes étant la plus fréquemment rapportée. Des fractures de stress se sont produites du côté dominant dans 80 % des cas.
Étiopathogénie
Les fractures de fatigue des côtes moyennes ont été particulièrement bien étudiées chez les rameurs. Il s’agit de l’aviron et également du canoë. Cependant, d’autres sports tel le golf ou le lancer chez les joueurs de baseball ont été rapportés.
Les mécanismes lésionnels
Ils semblent être en relation avec une tension d’une part du muscle dentelé antérieur et d’autre part du muscle oblique externe de l’abdomen.
Chez les rameurs
La position la plus contraignante pour les côtes se situe lors de la poussée, lorsque les mains sont les plus proches du corps, les épaules et les omoplates en arrière. C’est dans cette position que les deux muscles évoqués ont la plus forte contraction. C’est souvent dans cette phase que le rameur expire.
Pour Vinther, qui a réalisé une étude couplant la vidéo et l’électromyographie, ces fractures se créent en raison d’un mouvement de compression itérative de la cage thoracique et de contraction isométrique excessive des muscles thoraciques lorsque le rameur tire les rames dans l’eau, notamment en tout début du mouvement. Ce phénomène semble aggravé par la fatigue du grand dentelé qui ne remplit plus son rôle de fixateur de l’omoplate.
Les facteurs de risque
Chez les rameurs
MacDonnell a recherché les facteurs de risque intrinsèque de survenue lors de ces fractures :
• faible endurance du grand dentelé antérieur ;
• manque de mobilité des hanches et du rachis lombaire qui oblige à compenser en augmentant l’abduction scapulaire en fin de mouvement ;
• pathologie de l’épaule du rachis qui oblige le rameur à compenser ;
• faible densité osseuse, notamment chez les rameuses de faible poids, ayant des troubles hormonaux ou suivant un traitement contraceptif.
Chez les fondeurs
Les spécialistes donnent un certain nombre de pistes pour expliquer cette nouvelle explosion de pathologies :
• le surentraînement est un facteur essentiel et Martin Sundby, numéro 1 mondial, 2015, connu pour son assiduité hors norme à l’entraînement, a présenté, cette année-là, une FFC ;
• la pratique de plus en plus répandue du ski-roue qui, par les impacts répétés des bâtons sur le goudron, est bien plus traumatisante que le ski sur neige ;
• l’excès de musculation (?) et/ou sa mauvaise gestion.
• la double poussée (?) et l’absence de prévention de l’excès de la gestuelle trop répétitive de la double poussée qui est actuellement “la technique qui gagne” en style classique ;
• les bâtons trop longs (pour augmenter le bras de levier en double poussée) et trop rigides…
En règle générale, tout changement de rythme, de durée ou d’intensité de l’entraînement peut favoriser ce type de fracture, mais aussi tout changement de matériel.
Dans les années 1990, l’avènement des rames Big Blade plus larges, plus courtes et asymétriques, mais aussi plus efficaces dans la poussée, avait fait monter en flèche le nombre de FFC.
Chez les golfeurs
Un certain nombre de publications ont été réalisées pour le golf. Les FFC semblent plus volontiers se situer chez les débutants (Duffers fracture) avec un pic de fréquence aux environs de 8 semaines de pratique. Elles se situent à la partie postéro-latérale entre la quatrième et sixième côtes et elles représentent près de 70 % des FFC pour Alexander. La mauvaise exécution du swing avec les fameuses escalopes, un grand dentelé insuffisant, une raideur du tronc en rotation sont sans doute des facteurs favorisants.
Le backswing et le finish sont réalisés grâce à une rotation importante de la cage thoracique. Cette rotation s’effectue au niveau du rachis dorsal et pourrait être beaucoup plus importante si la cage thoracique ne lui opposait pas une résistance mécanique. Chaque vertèbre entraîne la paire de côtes correspondantes, mais la déformation de ces côtes est limitée par la présence du sternum en avant desquelles elles s’articulent par l’intermédiaire des cartilages costaux. La rotation de la vertèbre va s’accompagner d’une déformation de la paire de côtes qui lui est associée grâce à l’élasticité de la côte et du cartilage costal. Côte, cartilages costaux et sternum contribuent donc à limiter l’amplitude de la rotation du rachis dorsal. Quelques cas ont également été décrits lors de la pratique du baseball et de la natation.
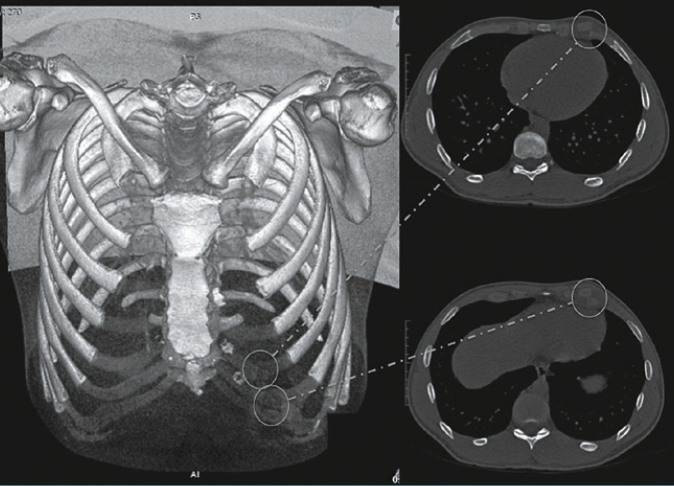
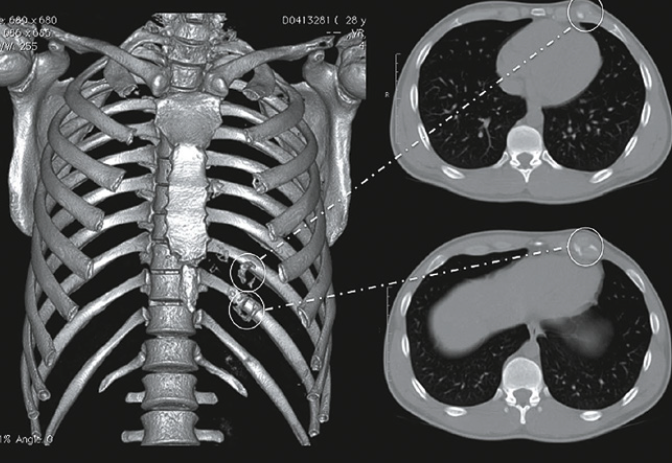
Le cas particulier de la fracture de fatigue de la première côte (Fig. 7)
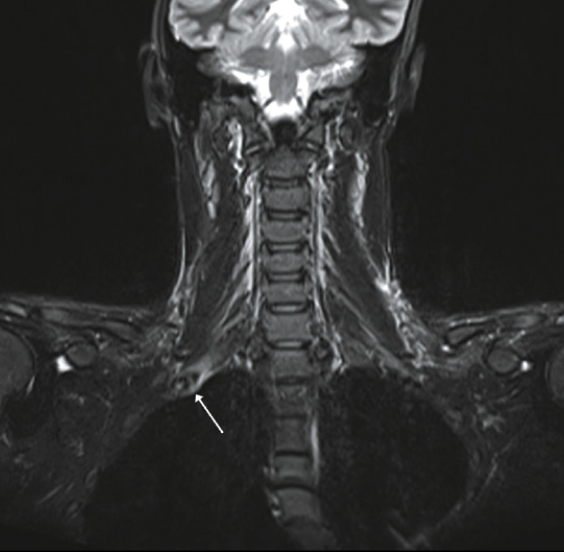
Chez les golfeurs
« Cette côte se trouve très comprimée en haut du backswing. Cette localisation est l’apanage de joueurs de haut niveau qui forcent l’amplitude de leur backswing pour augmenter la puissance et donc la longueur du drive. La fracture de fatigue atteint l’arc antérieur de la côte. » Habituellement, chez un droitier, c’est le côté gauche pour Poux qui est atteint.
Les types de fractures de fatigue de la première côte
Kawashima a proposé en 2020 une classification en trois types des fractures de fatigue de la première côte en fonction de la localisation :
• type 1, center-transverse fracture ;
• type 2, center to posterior-oblique fracture ;
• type 3, posterior-transverse fracture.
Les lignes de fracture des types 1 et 2 étaient sur la gouttière profonde de l’artère sous-clavière entre les attaches musculaires scalène antérieur et moyen, qui est la partie la plus mince et la plus faible de la première côte. Cependant, la ligne de fracture de type 3 était à travers la partie postérieure de la première côte et située légèrement à distance de la gouttière profonde de l’artère sous-clavière.
Elle a été également décrite lors de la pratique du baseball ou du basket-ball, où on la surnomme rebounders rib, mais aussi tennis, football américain, natation, musculation…
Chez les lanceurs
Dans 80 % des cas, c’est le bras dominant qui est touché, mais il existe quelques atteintes de l’autre côté. Une étude récente sur une série de 25 cas chez des lanceurs montre que la moyenne d’âge est de 17 ans.
Les signes cliniques
Les côtes moyennes
À ce niveau, elles sont en général d’apparition progressive sur plusieurs jours, plusieurs semaines. Cette douleur apparaît sans traumatisme initial et progressivement. Parfois, à la suite d’un mouvement simple, il existe une aggravation brutale. Les douleurs sont localisées au niveau de la cage thoracique, aggravées par les mouvements d’inspiration forcée et la toux. Les changements de position peuvent être pénibles, mouvements de l’épaule, mouvements du tronc. Il peut apparaître des irradiations sur le trajet des nerfs intercostaux. La palpation méthodique du gril costal retrouve une zone exquise permettant de localiser l’origine de la douleur et donc la côte impliquée.
La première côte
Le diagnostic est plus difficile à poser. L’apparition de la douleur est souvent progressive et elle peut durer plusieurs mois. On note des douleurs sous l’épaule, au niveau de l’omoplate. Parfois, il existe des paresthésies au niveau des membres supérieurs, voire des douleurs de type neuropathique qui égarent le diagnostic vers un problème neurologique. La toux, l’inspiration profonde exacerbent la douleur ainsi que les mouvements des bras au-dessus des épaules. Il peut exister également des signes neurovasculaires mal systématisés dans le membre supérieur ou des signes évoquant un syndrome du défilé thoracique. Un test, décrit par Prisk, le trapezius squeez test, consiste à pincer la musculature située au-dessus de la côte avec réveil de la douleur. La palpation de la fracture est également douloureuse. Pour la première côte, le mouvement d’adduction forcée du bras homolatéral est douloureux.
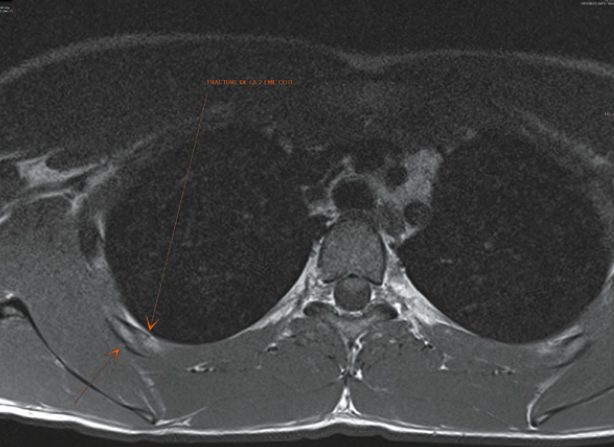
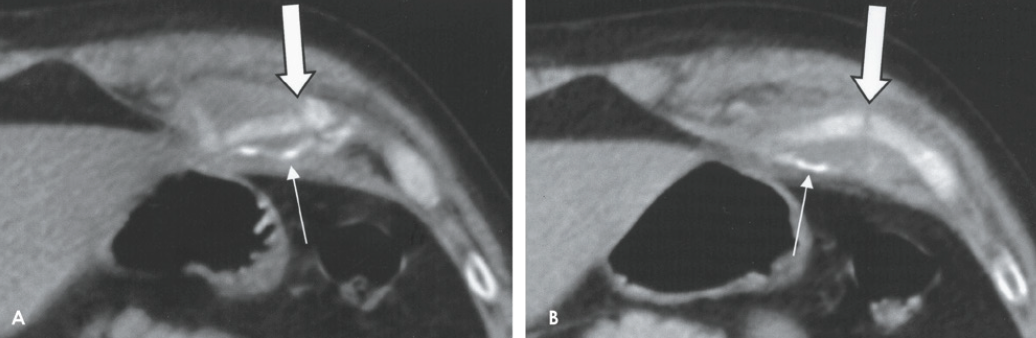
L’imagerie
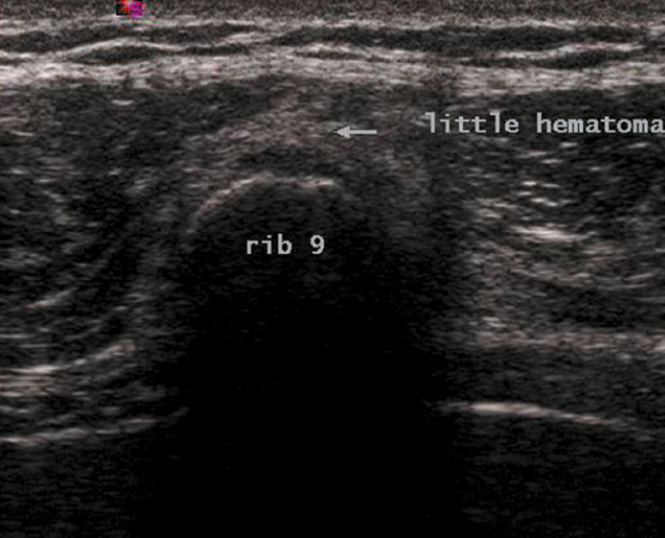
La radiographie est le plus souvent normale, faussement rassurante et ce sont des examens en coupe, qu’il s’agisse d’un scanner ou d’une résonance magnétique (Fig. 8), qui permettent de faire le diagnostic. Parfois, la scintigraphie est nécessaire. L’échographie peut se révéler un excellent examen de dépistage pour les côtes moyennes (Fig. 9). En aigu, elle montre l’interruption de la ligne hyperéchogène de la corticale et l’hématome hypoéchogène de voisinage. En cas de mobilisation des fragments, un hématome hyperéchogène peut infiltrer les muscles adjacents. Parfois, le trait est à peine visible et la lésion se manifeste par un décollement cortico-périosté ou par une petite irrégularité superficielle. Progressivement, on va pouvoir noter les images de cal.
Le traitement
Le repos
Dans un premier temps, un repos relatif est utile, associé à des antalgiques. À la phase douloureuse initiale la plus forte, une immobilisation “relative”, par plusieurs épaisseurs de bandes collantes élastiques collées sur la zone de fracture, est le moyen le plus employé.
Le délai de cicatrisation est habituellement de 4 à 6 semaines, surtout quand il n’existe pas un véritable trait de fracture. Par contre, si celui-ci s’est complété, le délai peut être beaucoup plus long et peut nécessiter 6 à 12 mois de repos. Il faut bien sûr profiter de cette période pour limiter les facteurs de risque, et notamment les facteurs techniques. Les fractures de fatigue de côte peuvent être isolées, mais elles peuvent également être multiples, augmentant la durée consolidation.
Une étude de 2019 de Funakoshi, portant sur 25 cas de FF de la première côte, a mis en évidence une guérison dans 71 % des cas avec une moyenne de 7 mois et demi avec un traitement conservateur.
La chirurgie
Dans quelques cas, un traitement chirurgical a pu être proposé avec résection de la première côte.
Les complications
Le défaut de consolidation
Le problème essentiel vient d’un défaut de consolidation, en particulier au niveau de la première côte. Heureusement, dans la plupart des cas, cette pseudarthrose n’est pas douloureuse et n’empêche pas le sportif de reprendre le sport à son niveau.
Un cal osseux volumineux
Les principales complications viennent du volumineux cal osseux qui peut survenir dans cette pseudarthrose. Au niveau de la première côte, le cal osseux peut être compressif et provoquer un syndrome du défilé thoraco-brachial ou syndrome de Claude Bernard Horner ou des lésions partielles du plexus brachial. C’est ce qui explique que, dans quelques rares cas, une prise en charge chirurgicale soit nécessaire.
Diagnostic différentiel
L’un des problèmes essentiels des douleurs thoraciques est de ne pas méconnaître une pathologie grave, notamment cardiaque pulmonaire. Une étude de 2013 est intéressante, car elle a répertorié une longue série de douleurs thoraciques chez les patients se présentant aux urgences pour cette douleur :
• dans 46,6 % des cas, il s’agissait d’une douleur de la paroi thoracique,
• dans 14,8 % des cas, un problème aigu coronarien,
• dans 9,5 % des cas, de désordres psychologiques,
• dans 8,1 % des cas, une infection respiratoire,
• dans 4 % des cas, une poussée hypertensive,
• dans 3,5 % des cas, une pathologie digestive de type reflux.
3/ La pathologie des cartilages costaux
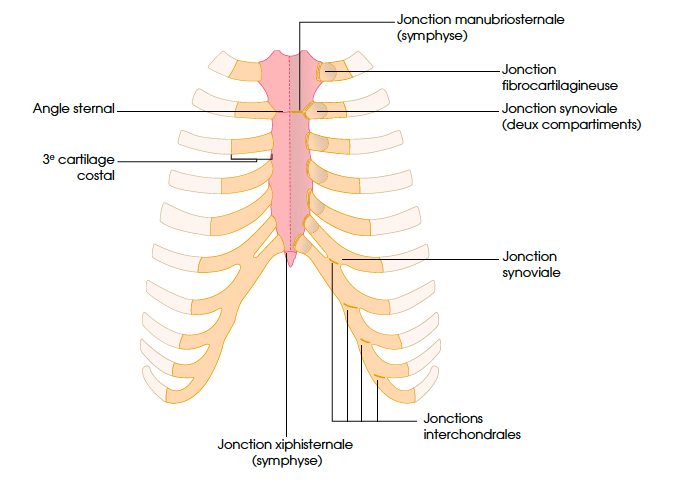
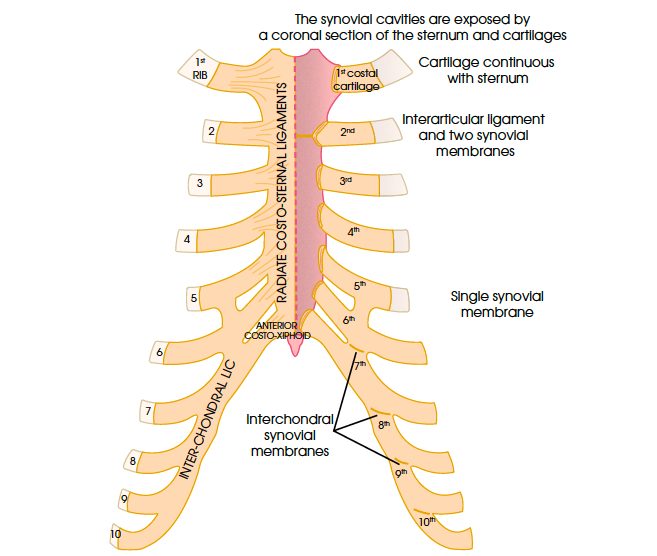
Anatomie des cartilages costaux
Les cartilages costaux sont des cartilages hyalins. Ils sont plus arrondis que les côtes. Ils forment la jonction mobile entre les côtes et le sternum (Fig. 10). Leur longueur augmente de la première à la septième côte et diminue de la septième à la douzième côte.
Épidémiologie et étiopathogénie
La portion osseuse semble plus solide que la portion cartilagineuse pouvant donc expliquer certaines blessures. L’incidence des blessures costochondrales/sternales se situe autour de 2,4 % pour 1 000 heures-joueurs en rugby professionnel anglais selon Brooks. MacAdams estime que, dans la ligue professionnelle de football américain, il existe environ une fracture par an dans chaque équipe.
Les sports à risque
Les sports qui nécessitent des manœuvres de rotation prédisposent les athlètes à des fractures costochondrales au niveau de la partie haute des premières et deuxièmes côtes, en revanche ces fractures semblent beaucoup plus fréquentes dans les sports de contact au niveau des côtes basses, par exemple lors du hockey ou du rugby.
La clinique
Localisation de la lésion
La pathologie touche habituellement les sujets autour de la trentaine, un peu plus chez des sujets de sexe masculin. La localisation à la première côte est la plus fréquente (Fig. 11), peut-être liée à un facteur anatomique : le premier cartilage costal est, en effet, uni à la fois à la côte osseuse et au sternum par des synarthroses, tandis que les cartilages sous-jacents sont liés au sternum par des diarthroses, avec cavités synoviales rudimentaires.
La douleur
Lors du traumatisme, le sportif ressent une vive douleur, latéralisée, bien localisée. L’activité sportive doit être interrompue. Bien souvent, du fait de cette douleur inquiétante dans la poitrine, le joueur est adressé aux urgences.
L’examen clinique
Il retrouve une sensibilité à la palpation de la cage thoracique du côté touché. Parfois, lors de la pression de la zone douloureuse, un “clic” est entendu ou ressenti par le joueur. Il est régulièrement palpé et reconnu par le patient avec la manœuvre de Valsalva et les mouvements de torsion. Il peut exister également une asymétrie de la paroi thoracique.
Les lésions
Ces lésions fracturaires peuvent être observées à distance d’un traumatisme “méconnu” lors de la pratique de sports de contact, sports de combat, football américain, rugby… Les lésions se présentent cliniquement comme des masses douloureuses, évoquant un processus tumoral. Le risque d’erreur diagnostique est possible même dans des cas où une biopsie est réalisée, car celle-ci peut révéler un tissu chondroïde remanié, avec des atypies cellulaires suggérant une tumeur maligne.
L’imagerie
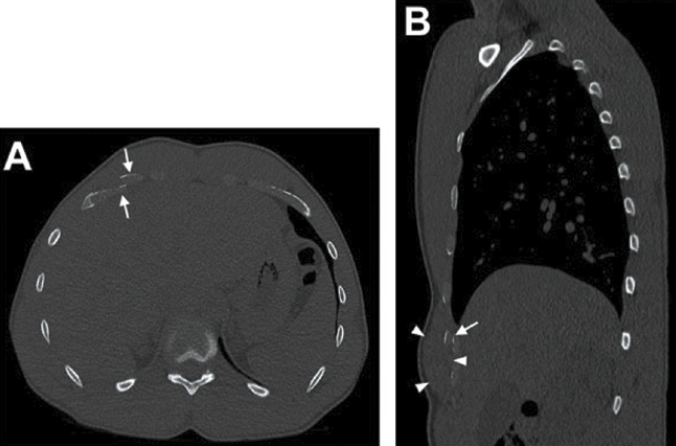
Les cartilages costaux, radio-transparents, ne deviennent visibles que suite à l’apparition à l’âge adulte de calcifications/ossifications, dont la topographie diffère selon le sexe (calcifications essentiellement centrales chez les femmes et périphériques chez les hommes). En revanche, les cartilages costaux non calcifiés sont bien individualisables par échographie, TDM ou IRM (Fig. 12-17).
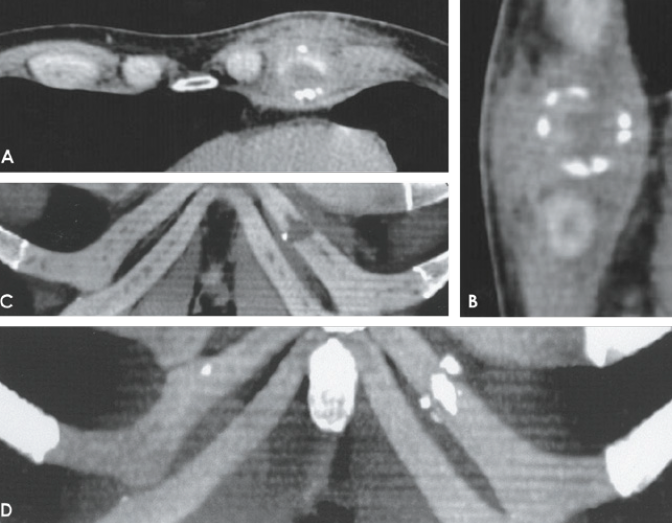
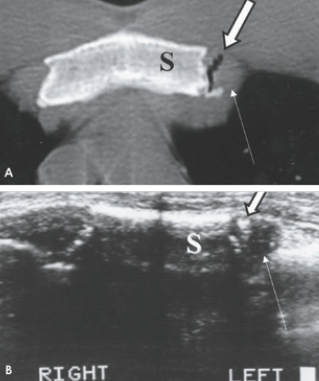
L’échographie
En échographie, les cartilages costaux sont hypoéchogènes et délimités par une fine bande hyper-
échogène correspondant à leur face superficielle. En cas de lésion, on note une discontinuité dans la surface hyperéchogène du cartilage, avec éventuel décrochement dans son alignement.
La TDM
En TDM, la densité des cartilages costaux est relativement uniforme, supérieure à celle des muscles et inférieure à celle de l’os. Le diagnostic repose :
• sur une anomalie focale de densité dans tous les cas,
• sur un déplacement des berges de la fracture,
• sur une tuméfaction des tissus mous adjacents,
• sur la présence de calcifications autour des lésions chronicisées
• et sur la présence d’une fine clarté linéaire gazeuse résultant d’un phénomène de vide dans la fente cartilagineuse
L’IRM
En IRM, ces cartilages sont en signal faible en pondération T1 et très faible en pondération T2. Ils sont individualisables essentiellement par contraste avec les couches graisseuses adjacentes en signal intense en T1 et intermédiaire en T2. La ligne fracturaire peut être détectée par un signal intense en pondération T2, mieux visible avec saturation du signal de la graisse (ou en STIR) ou en écho de gradient. Un aspect de type œdémateux est également présent dans les tissus mous adjacents en cas de lésion récente (< 3 mois), mais manque dans les lésions anciennes (> 6 mois).
Le traitement
Traitement conservateur et résection tardive
Le traitement est généralement conservateur, avec atténuation progressive des symptômes qui s’effectue en plusieurs mois. En raison de son caractère cliniquement inquiétant, une biopsie peut être demandée dont l’interprétation n’est pas toujours simple. Une résection tardive du site fracturaire cartilagineux en chevauchement, en raison d’une gêne persistante, peut être demandée par le patient pour une gêne ou un problème esthétique.
Des protections locales
En moyenne, le temps de guérison est de 3 à 12 semaines. Dans certains cas, il peut exister des sensations de claquements malgré des images rassurantes qui signent sans doute une mobilité du foyer de fracture. Des protections locales peuvent être utilisées pour l’activité sportive qui engendre des traumatismes (Fig. 18). Elles sont indispensables dans certaines localisations. En effet, il existe des possibilités de complications secondaires en cas de nouveaux chocs, notamment un embrochage viscéral. Willis-Owen a rapporté un athlète de rugby de 29 ans qui a subi une lacération hépatique et un hématome secondaire à une fracture déplacée droite cinquième et sixième de la jonction costochondrale. Dans la ligue de football professionnel aux États-Unis, certains médecins d’équipe utilisent des blocs anesthésiques.

4/ Le syndrome de Tietze et la costochondrite
Le syndrome de Tietze
Étiopathogénie
Les éléments cliniques de ce syndrome ont été décrits en 1921 par un professeur allemand de chirurgie, Alexander Tietze (Fig. 19). On note une inflammation du cartilage costosternal (cartilage à la jonction du sternum et d’une ou plusieurs côtes), le plus souvent localisée au niveau des deuxième et troisième côtes, non purulente, avec un œdème dans près de 80 % des cas. L’affection est le plus souvent unilatérale.
Les causes
L’étude pathogénique de ce syndrome est mal connue. Pour certains, il existe des facteurs microtraumatiques et/ou des facteurs infectieux, rhumatologiques, néoplasiques.
Les causes du syndrome de Tietze (ST) sont variées. Il peut s’agir d’un choc direct, d’une souffrance en relation avec une arthrose localisée, bien souvent lors de mouvements répétitifs occasionnés par la pratique sportive. Il n’y a aucun lien de causalité entre ST et la profession, l’origine ethnique ou géographique, cependant, des cas groupés ont été signalés. La période la plus fréquente pour contracter cette pathologie se situe pendant la période hiver-printemps.
Une étude de Boran (2009-2013) retrouve réalisée sur 32 741 patients avec un diagnostic de douleur thoracique à l’hôpital. 431 patients présentaient une costochondrite et 24 un ST avec 66 % de femmes d’âge moyen 34 ans. La guérison a été obtenue en moyenne en 3 semaines et les taux de récidive étaient faibles.
La clinique
La douleur peut apparaître de manière progressive ou brutale. Les douleurs thoraciques sont parfois importantes, localisées au niveau de la deuxième ou troisième côte et au niveau du sternum et ce, de manière unilatérale. Elles sont accentuées par la palpation, par certains mouvements, notamment de torsion, la toux ou l’inspiration profonde. Dans la grande majorité des cas, les paramètres biologiques restent normaux. On peut noter une rougeur, un gonflement au niveau de la zone douloureuse.
La palpation est pénible. Le diagnostic est avant tout clinique, le problème essentiel est d’exclure un diagnostic différentiel cardiovasculaire, pulmonaire. Les costochondrites sont des diagnostics différentiels qui peuvent être également difficiles.
L’imagerie
L’imagerie n’est pas indispensable, mais utile pour écarter un diagnostic différentiel. L’échographie est sans doute la meilleure technique qui permet de voir le gonflement des tissus mous dans la zone de l’inflammation. La résonance magnétique met en évidence également des phénomènes inflammatoires dans les tissus autour de l’articulation avec un œdème osseux éventuel. Il n’y a pas d’élément destructif au niveau de l’os et du cartilage. Certains recommandent l’utilisation de la scintigraphie osseuse pour différencier la pathologie de type ST avec une costochondrite dans laquelle des changements inflammatoires importants au sein de la structure des côtes sont évidents.
Le traitement
La douleur disparaît habituellement en quelques jours, 1 à 2 semaines, avec un traitement local anti-inflammatoire, des antalgiques, du repos.
En cas de diagnostic incertain, une infiltration locale anesthésique peut être utile. Parfois, on a recours à des infiltrations locales de corticoïdes guidées sous échographie.
La costochondrite
Étiopathogénie et épidémiologie
La costochondrite est le diagnostic différentiel du ST le plus fréquent. La zone pathologique se situe à la jonction de la côte et du cartilage costal. Elle peut toucher aussi bien les enfants que les adultes. Elle est beaucoup plus fréquente.
Dans une étude prospective de patients se présentant aux urgences avec des douleurs thoraciques, 30 % des adultes et 15 % des adolescents avaient une costochondrite.
La clinique
Le principal symptôme de la costochondrite est une douleur de la paroi thoracique d’intensité variable, généralement décrite comme aiguë, pénible à type de coup de couteau, ou semblable à une pression forte. La douleur est souvent exacerbée par les mouvements du haut du corps, la respiration profonde et les activités physiques.
Les antécédents de maladie antérieure avec toux, exercice intense récent ou activités physiques qui utilisent les membres supérieurs sont courants. Bien que les deuxième à cinquième articulations costochondrales soient le plus souvent affectées, en particulier les côtes trois et quatre, n’importe laquelle des sept jonctions costochondrales peut être impliquée. La douleur peut être notée à plusieurs endroits dans 90 % des cas, le plus souvent, elle est unilatérale. Un élément essentiel est l’absence de signe inflammatoire ou de gonflement local.
L’imagerie
On ne retrouve jamais d’association avec des pathologies infectieuses tumorales… Les examens complémentaires tels que radiographie thoracique, tomodensitométrie ou scintigraphie ne sont utiles que pour exclure les infections ou les néoplasmes en cas de suspicion clinique.
Le traitement
Le traitement associe :
• les médications anti-inflammatoires non stéroïdiennes,
• les applications locales de compresses de chaleur et de glace,
• la thérapie manuelle avec exercices d’étirement,
• les injections de corticostéroïdes en cas d’échec des traitements précédents.
L’évolution dans 90 % des cas est favorable en 3 semaines. Beaucoup plus rarement, elle peut s’étaler sur 1 an ; il faut savoir rassurer ces patients sur cette pathologie bénigne.
5/ Le syndrome de Cyriax ou slipping rib syndrom
Le syndrome douloureux du rebord costal a été décrit pour la première fois en 1919 par le chirurgien orthopédiste anglais Cyriax. D’autres appellations ont suivi :
• côte glissante : slipping rib,
• côte claquante : clicking rib,
• syndrome de l’extrémité costale : rib tip syndrome,
• syndrome de la côte douloureuse : painful rib syndrome.
Étiopathogénie
Le syndrome de Cyriax se caractérise par une douleur due à une luxation chondrocostale d’une des dernières côtes, huitième, neuvième et dixième, qui emprisonne un nerf intercostal dont la compression, lors de certains mouvements ou de certaines postures, déclenche la douleur. La cause est toujours traumatique de façon directe ou indirecte, même si ce traumatisme passe souvent inaperçu.
Le mécanisme physiopathologique
Le mécanisme physiopathologique est bien connu. L’extrémité chondrale luxée comprime le nerf intercostal qui chemine sous la côte supérieure. La douleur se propage alors en aval dans l’hypochondre droit ou gauche dans le territoire sensitif cutané du nerf intercostal et en amont par la racine postérieure du nerf rachidien à la chaîne sympathique paravertébrale et aux ganglions péri-viscéraux. Il existe normalement une fusion antérieure des cartilages des huitièmes, neuvièmes et dixièmes côtes qui stabilisent la partie inféro-médiale du gril costal.
Cependant, de nombreuses variantes sont possibles, en particulier chez certains patients dont les cartilages antérieurs ne sont pas fusionnés à leur extrémité distale. Ils peuvent ainsi être à l’origine d’une friction douloureuse en se mobilisant.
La clinique et l’imagerie
La douleur est très trompeuse, entraînant de fréquentes erreurs de diagnostic. Elle est toujours provoquée par une mobilisation de la paroi, une inspiration profonde, une forte toux. La flexion du tronc en avant qui réveille la douleur signe quasiment le diagnostic. Elle est calmée par le repos absolu et le décubitus homolatéral. La palpation du rebord costal entraîne une douleur à un point précis correspondant à l’articulation lésée. Les côtes concernées sont par ordre de fréquence la dixième, la neuvième et la huitième. L’évolution spontanée est imprévisible, le plus souvent elle se fait par paroxysmes.
La technique d’imagerie par ultrason de type échographie semble un apport diagnostique tout à fait fiable, d’autant qu’elle est associée à des manœuvres dynamiques.
Une étude de Foley portant sur 54 athlètes a été menée. 70 % des athlètes touchés étaient des femmes avec une moyenne d’âge de 19 ans ; il existait bien souvent un retard au diagnostic qui était en moyenne de 15 mois. La manœuvre du crochet réalisé systématiquement était positive dans 40 % des cas. Les symptômes étaient unilatéraux dans 90 % des cas, la côte la plus symptomatique est :
• la dixième côte dans 44 % des cas,
• la huitième et la neuvième dans 31 % des cas chacune.
La plupart du temps, la douleur était rapportée comme étant survenue de manière insidieuse à la suite de courses, de jeu de hockey, de sports nécessitant de ramer… Plus de 22 % des athlètes ont été considérés comme ayant une pathologie psychologique.
Le traitement
Médical
Le traitement est médical, à base d’antalgiques purs ou d’anti-inflammatoires non stéroïdiens. Néanmoins, on a souvent recours à des infiltrations locales d’anesthésique pour affirmer le diagnostic, et de corticoïdes éventuellement. Lorsque les douleurs sont vives, l’infiltration locale d’anesthésique fait céder immédiatement la douleur. La guérison peut survenir après une à quatre infiltrations. Dans les douleurs modérées, il est conseillé le port d’un demi-bandage élastique pendant 1 à 2 semaines, associé à des antalgiques per os.
Chirurgical
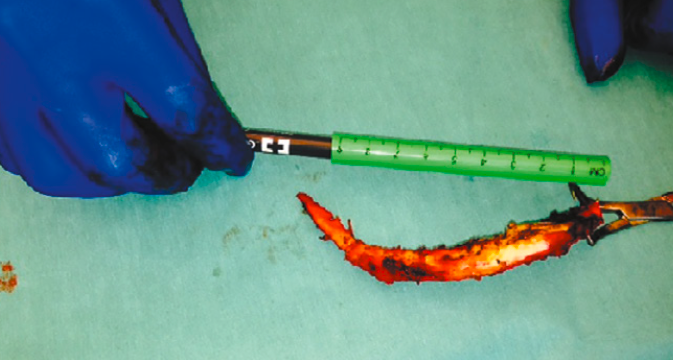
En cas d’échec du traitement médical, et de certitude diagnostique, un traitement chirurgical qui consiste en la résection des 5 à 8 derniers centimètres du cartilage luxé est proposé (Fig. 20). Cette indication est rarement nécessaire (4 % dans la série de Barki sur 100 cas). Selon Mazella (2020), qui est intervenu sur 19 patients, les résultats sont bons, mais loin d’être parfaits. La plupart des patients estiment cependant que l’intervention chirurgicale a été favorable.
Bibliographie
1. La cage thoracique
• Gonzalez M, Perentes JY, Abdelnour E et al. Prise en charge du thorax en entonnoir. Rev Med Suisse 2013 ; 9 : 1312-16.
2. La fracture de fatigue des côtes
• Bosner S, Bonisch K, Haasenritter J et al. Chest pain in primary care: is the localization of pain diagnostically helpful in the critical evaluation of patients? –A cross sectional study. BMC Fam Pract 2013 ; 14 : 154.
• Vinther A, Kanstrup IL, Christiansen E et al. Exercise-induced rib stress fractures: potential risk factors related to thoracic muscle co-contraction and movement pattern. Scand J Med Sci Sports 2006 ; 16 : 188-96.
• Satou S, Konisi N. The mechanism of fatigue fracture of the ribs. Nihon Seikeigeka Gakkai Zasshi 1991; 65 : 708-19.
• Palierne CC, Lacoste A, Souveton D. Aviron de haut niveau et fractures de fatigue de côtes (à propos de 12 cas). J Trauma Sport 1997 ; 14 : 227-34.
• Mintz AC, Albano A, Reisdorff EJ et al. Stress fracture of the first rib from serratus anterior tension: an unusual mechanism of injury. Ann Emerg Med 1990 ; 19 : 411-4.
• Mikawa Y, Kobori M. Stress fracture of the first rib in a weightlifter. Arch Orthop Trauma Surg 1991 ; 110 : 121-2.
• Rolland E. Fractures de fatigue du gril costal chez le sportif. In: Rodineau J, Vuillemin V, Brasseur JL. Microtraumatologie du sport : de la clinique et de l’imagerie au traitement. Sauramps médical, 2019 : 101-4.
• McDonnell LK, Hume PA, Nolte V. Rib stress fractures among rowers: definition, epidemiology, mechanisms, risk factors and effectiveness of injury prevention strategies. Sports Med 2011 ; 41 : 883-901.
• D’Ailly PN, Sluiter JK, Kuijer PP. Rib stress fractures among rowers: a systematic review on return to sports, risk factors and prevention. J Sports Med Phys Fitness 2016 ; 56 : 744-53.
• Harris R, Trease L, Wilkie K, Drew M. Rib stress injuries in the 2012-2016 (Rio) Olympiad: a cohort study of 151 Australian Rowing Team athletes for 88 773 athlete days. Br J Sports Med 2020 ; 54 : 991-6.
• Funakoshi T, Furushima K, Kusano H et al. First-rib stress fracture in overhead throwing athletes. Bone Joint Surg Am 2019 ; 101 : 896-903.
• Kawashima K, Terabayashi N, Asano H, Akiyama H. Classification of stress fractures of the first rib in adolescent athletes. J Pediatr Orthop B 2020 ; 29 : 409-11.
• Poux D. Technopathies du golf. Paris : Insep édition, 1995.
• Brasseur JL. Échographie de la paroi thoracique antérieure. In: Rodineau J, Vuillemin V, Brasseur JL. Microtraumatologie du sport : de la clinique et de l’imagerie au traitement. Sauramps médical, 2019 : 115-59.
• Lord MJ, Ha KI, Song KS. Stress fractures of the ribs in golfers. Am J Sports Med 1996 ; 24 : 118-22.
• Lee AD. Golf-related stress fractures: a structured review of the literature. J Can Chiropr Assoc 2009 ; 53 : 290-9.
• Funakoshi T, Furushima K, Kusano H et al. First-rib stress fracture in overhead throwing athletes. Bone Joint Surg Am 2019 ; 101 : 896-903.
3. La pathologie des cartilages costaux
• Lopez V Jr, Ma R, Li X et al. Costal cartilage fractures and disruptions in a rugby football player. Clin J Sport Med 2013 ; 23 : 232-4.
• Malghem J, Vande Berg B, Lecouvet F, Maldague B. Costal cartilage fractures as revealed on CT and sonography. Am J Roentgenol 2001 ; 176 : 429-32.
• Brooks JH, Fuller CW, Kemp SP et al. Epidemiology of injuries in English professional rugby union: part 1 match injuries. Br J Sports Med 2005 ; 39 : 757-66.
• McAdams TR, Deimel JF, Ferguson J et al. Chondral rib fractures in professional american football: two cases and current practice patterns among NFL team physicians. Orthop J Sports Med 2016 ; 4 : 2325967115627623
• Willis-Owen C, Kemp SP, Thomas RD. Hepatic injury after costo-chondral separation in a rugby football player. Clin J Sport Med 2009 ; 19 : 70-1.
• Subhas N, Kline MJ, Moskal MJ et al. MRI evaluation of costal cartilage injuries. Am J Roentgenol 2008 ; 191 : 129-232.
4. Le syndrome de Tietze et la costochondrite
• Tietze A. Über eine eigenartige Häufung von Fällen mit Dystrophie der Rippenknorpel. Berliner klinische Wochenschrift 1921 ; 58 : 829-31.
• Sawada K, Ihoriya H, Yamada T et al. A patient presenting painful chest wall swelling: Tietze syndrome. World J Emerg Med 2019 ; 10 : 122-4.
• Gijsbers E, Knaap SFC. Clinical presentation and chiropractic treatment of Tietze syndrome: A 34-year-old female with left-sided chest pain. J Chiropr Med 2011 ; 10 : 60-3.
• Kamel M, Kotob H. Ultrasonographic assessment of local steroid injection in Tietze’s syndrome. Br J Rheumatol 1997 ; 36 : 547-50.
• Boran M. Tietze syndrome and idiopathic costochondritis Treatment modalities, recurrence rates, seasonality. World J Pharma Res 2017 ; 6 : 76-85.
• Proulx AM, Zryd TW. Costochondritis: diagnosis and treatment. Am Fam Physician 2009 ; 80 : 617-20.
5. Le syndrome de Cyriax ou slipping rib syndrom
• Foley CM, Sugimoto D, Mooney DP et al. Diagnosis and treatment of slipping rib syndrome. Clin J Sport Med 2019 ; 29 : 18-23.
• Cyriax EF. On various conditions that may simulate the reffered pains of visceraldisease, and a consideration of these from the point of cause and effect. Practionner 1919 ; 102 : 314-322.
• Sanou S, Belembaogo E, Nzenze JR et al. Le syndrome de Cyriax : à propos de 35 observations. Med Afrique Noire 1999 ; 46 : 331-3.
• Bonasso PC, Petrus SN, Smith SD, Jackson RJ. Sternocostal slipping rib syndrome. Pediatr Surg Int 2018 ; 34 : 331-3.
• Barki J, Blanc P, Michel J et al. Painful rib syndrome (or Cyriax syndrome): study of 100 patients. Presse Med 1996 ; 25 : 973-6.
• Mazzella A, Fournel L, Bobbio A et al. Costal cartilage resection for the treatment of slipping rib syndrome (Cyriax syndrome) in adults. J Thorac Dis 2020 ; 12 : 10-6.
• Brasseur JL. Échographie de la paroi thoracique antérieure. In: Rodineau J, Vuillemin V, Brasseur JL. Microtraumatologie du sport : de la clinique et de l’imagerie au traitement. Sauramps médical 2019 : 115-59.
• Saltzman DA, Schmitz ML, Smith SD et al. The slipping rib syndrome in children. Paediatr Anaesth 2001 ; 11 : 740-3.
• van Delft EAK, van Oul KM, Boemers FW. The slipping syndrome: a case report. Int J Surg Case Rep 2016 ; 23 : 23-24.

