Les pathologies du thorax – Partie 2
Nous continuons, avec ce deuxième dossier, l’étude du thorax. Certes les fractures de fatigue du sternum sont rares, mais elles méritent d’être connues. La pathologie de l’apophyse xyphoïde est aujourd’hui mieux décrite grâce aux études anatomiques et aux avancées de l’échographie. Il faut savoir suspecter son rôle pathogène notamment lorsqu’il existe certaines malformations. Les pathologies des muscles pectoraux, largement sollicités lors de certains sports, doivent être dépistées, car il existe parfois une indication chirurgicale ou un problème de diagnostic différentiel.
6/ La fracture de fatigue du sternum
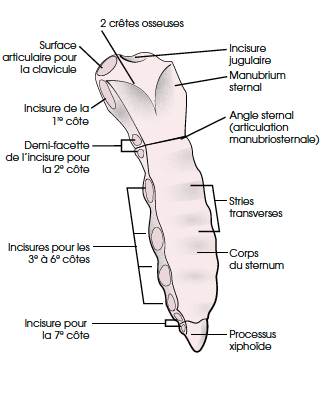
Anatomie du sternum
Le sternum est un os plat, impair, symétrique, situé au niveau de la partie antérieure de la cage thoracique sur lequel viennent s’attacher en avant les sept premières côtes chez l’Homme (Fig. 1). Les bords latéraux du sternum présentent des surfaces articulaires qui vont s’articuler avec les cartilages costaux. La deuxième surface articulaire est située à l’union du manubrium et du corps sternal. Cette union est en fait une articulation de type cartilagineux plus ou moins mobile. La septième surface articulaire est située à la jonction du corps sternal et du processus xiphoïde.
Le foramen sternal
Il a été pour la première fois observé en 1649 et décrit un peu plus tard en 1707. On le retrouve dans 2,5 à 13 % de la population ; il est plus fréquent chez les hommes que chez les femmes, mais pour d’autres il n’y a pas de différence. Il se rencontre plus communément dans les populations africaines dans près de 80 % des cas, situé au niveau du tiers inférieur du corps du sternum (Fig. 2).

Épidémiologie et étiopathogénie
La fracture de fatigue du sternum est une pathologie relativement rare, sans doute sous-estimée, même s’il existe très peu de publications.
Chez les haltérophiles et les tennismen
Elle a été décrite chez les sportifs qui effectuent de la musculation, notamment un mouvement nommé dips. McCurdle et Hill ont rapporté trois cas féminins chez des recrues militaires qui ont développé cette pathologie lors de la pratique de dips. Des atteintes chez les haltérophiles, les joueurs de tennis sont retrouvées dans la littérature.
Chez les golfeurs
Elles sont l’apanage des golfeurs de sexe masculin, haut niveau, puissants et qui ont un swing avec un finish en C. D’après Poux, « L’accélération du club vers l’impact se trouve brutalement bloqué lors de la phase freinatrice. Le poids du corps est supporté par la jambe gauche, la tête et de rachis cervical restent le plus possible sur la zone d’impact tandis que le rachis dorso-lombaire et le tronc effectuent une rotation gauche et une extension finale. L’exagération de ce phénomène caractérise le finish en C. La succession des contraintes en flexion, en rotation puis en extension finale associée aux contraintes musculaires exercées par les muscles abdominaux et pectoraux va favoriser ces fractures de fatigue. »
Localisation de la lésion
La lésion peut se situer :
• au niveau du manubrium (17 %)
• ou au niveau du corps du sternum (80 %).
La clinique et l’imagerie
La clinique
Le sportif se plaint d’une douleur lors de la toux, de la respiration profonde. La pratique du sport est limitée, voire impossible. Le début est le plus souvent progressif. Un cas a été décrit chez un adepte de la musculation qui a ressenti une douleur de début brutal lors d’efforts intenses avec une sensation de craquement du thorax ; un mouvement violent d’écartement des bras lors d’un saut à ski a eu le même effet. La palpation et la percussion du sternum réveillent la douleur.
L’imagerie
L’échographie
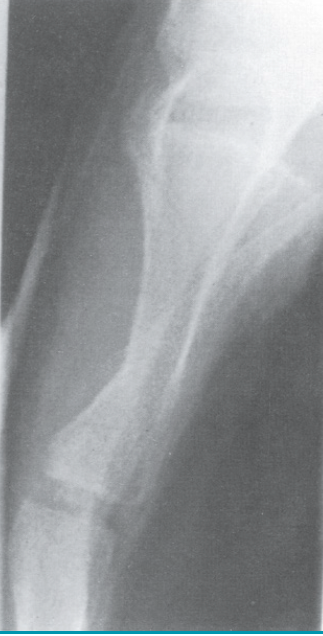
L’aspect échographique des fractures du sternum est souvent typique, mais le décrochage peut-être très limité, non visible sur les clichés standard. La découverte de cette fracture est parfois une surprise, car elle peut survenir chez les personnes minces et déminéralisées à la suite d’un effort violent qui entraîne une symptomatologie atypique. De simples déformations correspondant à de petits enfoncements peuvent également être visualisées. Le cliché du sternum de profil est bien entendu impératif pour analyser la face postérieure du sternum et un éventuel hématome à la partie antérieure du médiastin (Fig. 3 et 4).
La résonance magnétique
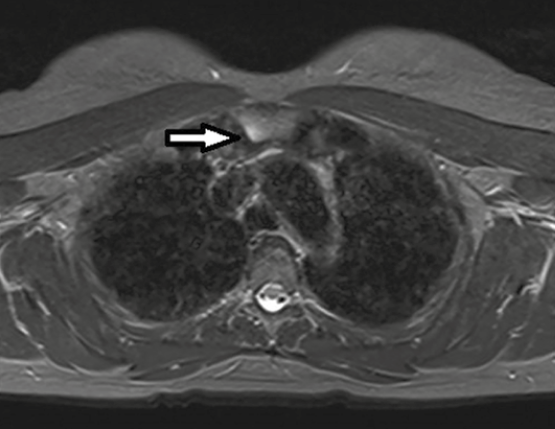
Le meilleur examen, s’il est disponible, est sans doute la résonance magnétique qui visualise particulièrement en T2 la zone d’œdème avec un éventuel trait mieux visible en T1 (Fig. 5 et 6).
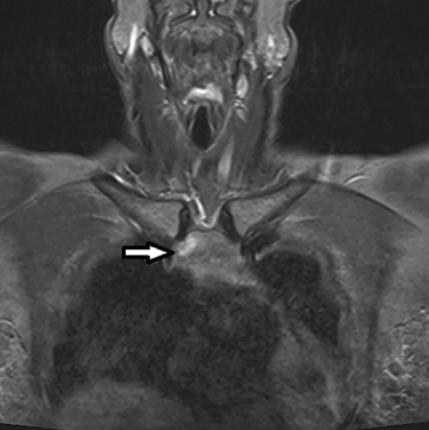
Le traitement
Quatre à 6 semaines de repos sont nécessaires pour obtenir une consolidation. Cependant, des douleurs résiduelles peuvent persister pendant 4 à 6 mois.
7/ La xiphodynie
Anatomie de l’appendice xiphoïde
Le processus xiphoïde, également appelé processus xiphysternum ou ensiforme, est un processus ostéocartilagineux qui est considéré comme le plus petit du sternum.
Des variations anatomiques
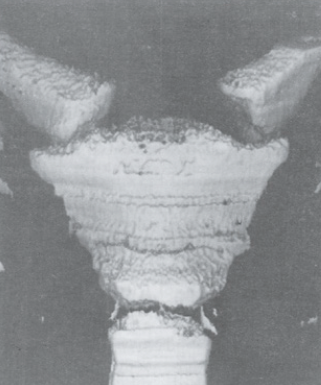
Les morphologies varient de pointues, bifurquées, trifurquées, larges, incurvées ou déviées (Fig. 7 et 8).
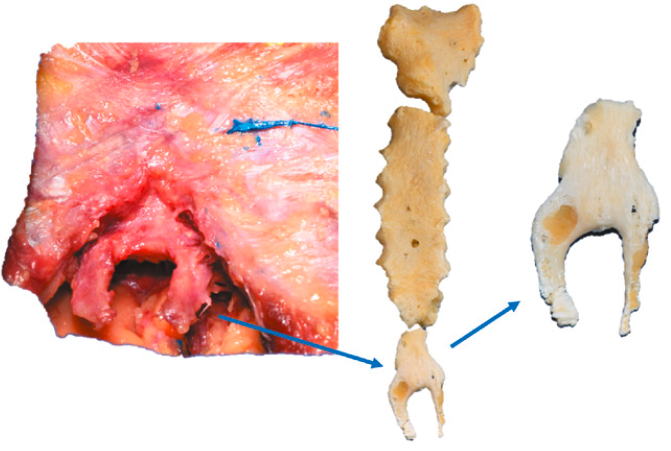
Au cours des premiers stades de la vie, il est de nature cartilagineuse puis se transforme en état ossifié plus ou moins complet chez l’adulte. Akin a documenté des variations du processus xiphoïde chez 500 patients par tomodensitométrie. La déviation est dorsale, 65 % contre 0,6 % en déviation ventrale en forme de crochet. Un processus xiphoïde unique a été trouvé dans 62,6 à 80 % des cas et bifide dans 20 à 40 % des cas.
Ces variations anatomiques sont importantes à prendre en compte afin de prévenir un diagnostic erroné lors des interventions radiologiques et de prévenir une lésion iatrogène lors des interventions thoraciques invasives.
En plus de morphologies variables, le processus xiphoïde semble présenter différentes caractéristiques au cours du développement.
L’innervation et l’insertion
Il existe un certain nombre de variétés anatomiques du processus xiphoïde, cependant, l’innervation et l’insertion des structures abdominales restent les mêmes. Une petite partie du m. rectus abdominis et le ligament costoxiphoïde antérieur sont attachés en avant, le ligament costoxiphoïde postérieur, certaines fibres du diaphragme et le muscle thoracique transversal sont attachés en arrière. Les aponévroses de l’oblique externe, de l’oblique interne et du muscle abdominal transversal sont attachées latéralement.
Étiopathogénie
Une importante question est de savoir pourquoi l’appendice xiphoïde peut devenir douloureux.
Une modification positionnelle
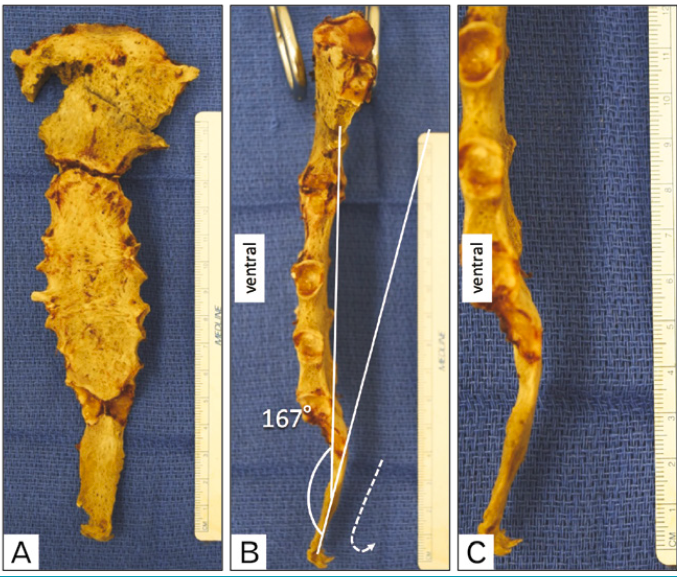
Il peut s’agir parfois d’une modification positionnelle. Le déplacement antérieur du processus xiphoïde peut être le résultat d’un gain de poids significatif (Fig. 9).
Maigne décrit une observation d’une grossesse qui s’était déroulée normalement et qui a abouti à une xiphodynie (Fig. 10 et 11).

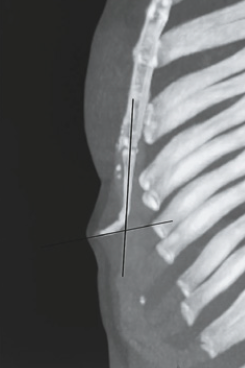
Il semble que l’augmentation du volume intra-abdominal puisse entraîner un effet mécanique sur cet appendice xiphoïde. Paradoxalement, il peut également s’agir d’une perte de poids importante qui entraîne ce déplacement (Fig. 12).
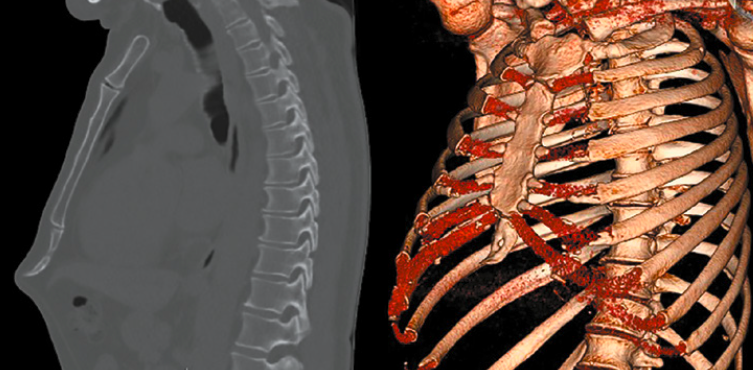
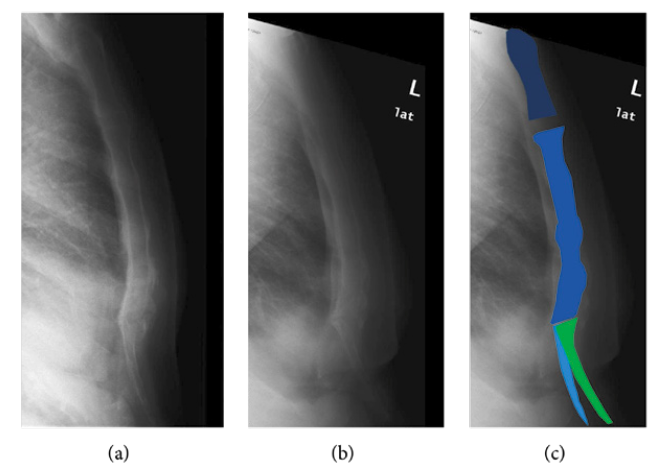
Des traumatismes répétés, le levage de poids, l’exercice intense…
Les traumatismes répétés de la zone touchée, le levage de poids inhabituel, l’exercice intense sont, entre autres causes, censés contribuer au développement de la xiphodynie (Fig. 13 et 14).
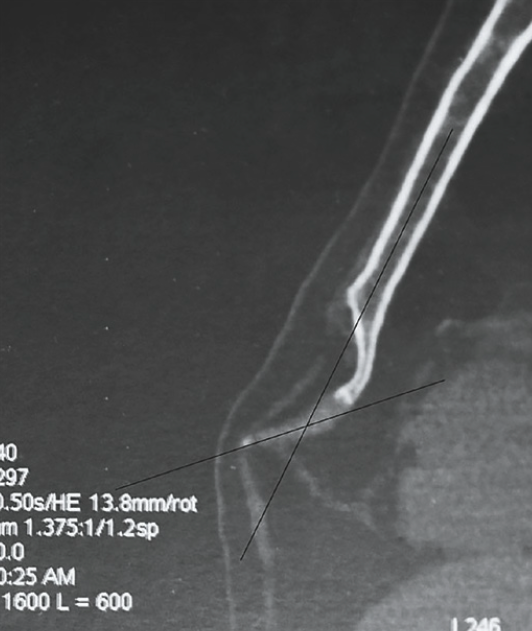
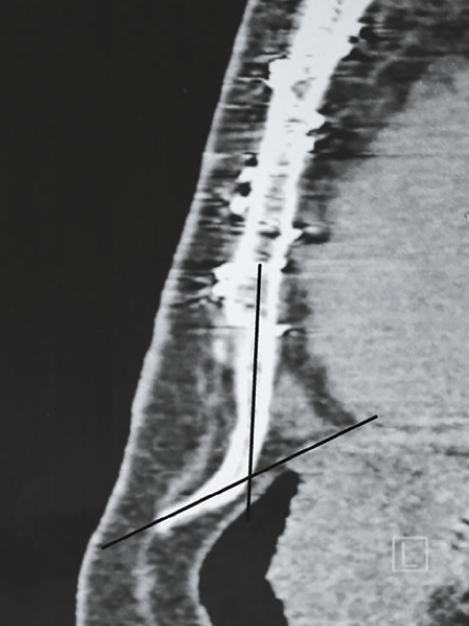
Au fil des ans, de nombreuses causes possibles de xiphodynie ont été suggérées dans la littérature, bien que l’on en sache encore très peu sur l’étiologie. Certaines publications suggèrent que l’inflammation due à des blessures mécaniques (répétées) pourrait contribuer à la causer. D’autres suggèrent que le déplacement antérieur de l’angle xiphisternal est une cause de proéminence du processus xiphoïde et donc sujet à des blessures mécaniques et à une inflammation secondaire. Enfin, certains auteurs suggèrent des traumatismes (micro) répétés du processus xiphoïde, tels que les lésions professionnelles, les lésions d’accélération et de décélération et les blessures liées au sport, comme principale cause dans l’étiologie de la xiphodynie.
Des malformations anatomiques locales
Les malformations anatomiques locales : xiphoïde bifide, trifide, orientée ventralement ou transversalement peuvent par elles-mêmes être l’objet de xiphodynie, voire dans quelques cas des facteurs irritatifs au niveau des organes intra-abdominaux, dont le foie. Une fracture du processus xiphoïde pourrait potentiellement perforer le foie ou le cœur.
La clinique
« Quand on entend une détonation, il vaut mieux se coucher avant de penser à un bouchon de champagne. » Cette phrase du chirurgien thoracique allemand Wetten résume l’état d’esprit que l’on doit avoir vis-à-vis des douleurs abdomino-thoraciques.
Avant tout, il faut éliminer tous les autres diagnostics : cardiaque, pulmonaire, abdominal avant d’envisager une xiphodynie comme seule étiologie d’une douleur. La simple palpation de l’apophyse xiphoïde peut-être déjà un élément diagnostique essentiel. On couple volontiers cet examen clinique à une échographie éventuellement, un test anesthésique.
L’imagerie
La radiographie est souvent difficile à interpréter. L’échographie semble être un moyen très efficace, peu coûteux, dynamique pour l’exploration de cette zone. Elle permet, entre autres, de visualiser la forme de l’appendice osseux et cartilagineux et éventuellement les rapports avec les viscères sous-jacents. On peut également visualiser un conflit avec le tissu sous-cutané à l’origine de la formation d’une bursite. Brasseur note également des conflits avec la ligne blanche, la face profonde de l’extrémité supérieure du droit de l’abdomen. Il retrouve un conflit possible avec la face antérieure du foie qui peut être douloureux même en dehors de traumatisme et dont il relève les douleurs atypiques possibles, car la capsule de Glisson est richement innervée et ces douleurs peuvent ne survenir que lors de certaines positions. On retrouve ici tout l’intérêt de l’aspect dynamique de l’échographie.
L’imagerie en coupes peut être trompeuse et les différents auteurs insistent sur des erreurs diagnostiques lorsqu’ils rencontrent une anomalie de forme de cette xiphoïde qui peut être confondue avec une masse tumorale.
Le traitement
Dans un premier temps, le traitement est local : mobilisation, infiltration. En cas d’échec, on peut être amené à effectuer une résection de l’appendice xiphoïde avec, semble-t-il, des résultats bons. Dorn rapporte une série de onze résections de la xiphoïde sur une période d’une douzaine d’années avec de bons résultats dans huit cas sur onze.
8/ La rupture du grand pectoral
C’est une pathologie méconnue, dont le diagnostic peut être retardé. Lors d’une revue de la littérature effectuée en 1999, Zeevaert recense une centaine de cas. En 2016, la publication de Balazs retrouvait, au sein de l’armée, 291 cas réunis entre 2012 et 2014 !
Particularités anatomiques du grand pectoral
C’est un muscle large et épais, qui présente, à l’origine, une insertion étendue de la partie antérieure du thorax jusqu’à la clavicule (Fig. 15). Les fibres convergent comme un éventail en trois plans, qui tournent l’un autour de l’autre à 90°, avant de se réunir pour s’insérer en un seul tendon. Le tendon mesure 5 cm de long et 5 mm de large, s’insère sur la lèvre antéro-externe de la coulisse bicipitale, latéralement par rapport au tendon du biceps.
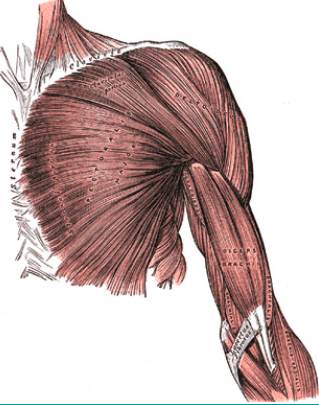
Le chef claviculaire et le chef sternal
On distingue classiquement deux chefs :
• le chef supérieur claviculaire
• et le chef inférieur ou chef sternal.
Le chef sternal est composé de deux portions, la portion supérieure ou manubriale et la portion inférieure ou abdominale. Il semble exister une différence histologique entre les portions supérieures où les fibres musculaires sont disposées de façon parallèle et la portion inférieure abdominale, où les fibres musculaires sont ramifiées.
Les fibres musculaires du chef claviculaire prennent leur origine sur la clavicule et la partie supérieure du sternum, restent parallèles pour aller s’insérer sur l’humérus. Elles constituent le plan antérieur. La portion manubriale du chef sternal prend son origine de la partie moyenne du sternum et des cartilages costaux des cinq premières côtes. Les fibres de la portion inférieure ou portion abdominale du chef sternal prennent leur origine des 5e et 6e côtes et du fascia du muscle oblique externe et transversalis. Leur trajet est presque vertical. Les portions manubriale et abdominale du chef sternal constituent respectivement les plans moyens postérieurs, qui tournent l’un autour de l’autre, de telle façon que les fibres abdominales s’insèrent haut sur l’humérus alors que les fibres manubriales s’insèrent plus bas.
Les actions du grand pectoral
Le grand pectoral présente différentes actions dépendant de la localisation du point fixe.
• Si le point fixe est situé à l’origine du grand pectoral sur le thorax, il est alors adducteur et rotateur interne de l’humérus.
• Si le point fixe est sur l’humérus, le bras en abduction, il intervient de façon accessoire dans l’élévation du gril costal lors de l’inspiration forcée.
De façon plus analytique, le chef claviculaire, chef supérieur, permet l’antépulsion et l’adduction horizontale du bras vers l’épaule opposée, tandis que le chef sternal, chef inférieur, permet l’abaissement et l’adduction horizontale du moignon de l’épaule.
Sur le plan fonctionnel, il intervient dans des gestes tels que le grimpé, le lancé ou encore dans des gestes de force requérant une bonne stabilisation proximale du membre supérieur : utiliser un tournevis, donner un coup de poing, faire une prise de judo.
Il joue un rôle essentiel dans le soutien du corps lors de la marche avec béquilles.
L’innervation est assurée par les nerfs grand et petit pectoral (C5, 6, 7, 8 et D1).
La vascularisation dépend de la branche pectorale de l’artère thoraco-abdominale.
Étiopathogénie et lésion anatomique
Épidémiologie
Dans l’armée américaine
Entre janvier 2012 et décembre 2014, une revue systématique de l’armée américaine a retrouvé 291 lésions opérées chirurgicalement pour une rupture du grand pectoral sur une période de 3 ans. L’incidence était de 60/100 000 personnes par an ; l’âge moyen de 30,5 ans. Tous les patients dans cette série étaient des hommes. Dans 40 % des cas, la rupture se situait au niveau de l’insertion et, dans 40 % des cas, au niveau de la jonction myotendineuse.
Chez les femmes
Un nombre de cas restreint a été décrit chez des femmes autour de la cinquantaine. Une revue systématique de la littérature en 2012 a identifié 11 cas de rupture du grand pectoral chez les femmes. L’âge moyen se situait entre 73 et 97 ans.
Les mécanismes lésionnels
Le mécanisme habituel de la lésion du grand pectoral est un mouvement forcé d’abduction et de rotation externe. La mise en tension excessive du muscle entraîne sa rupture. Le choc direct est moins fréquent et la rupture spontanée quasi exceptionnelle.
Les travaux expérimentaux de Wolfe
Ils ont mis en lumière les particularités des fibres inférieures du grand pectoral au niveau de son chef sternal, dont la mise en tension extrême au cours d’effort de levage conduit à des ruptures. Ce mécanisme s’inscrit dans l’exercice de nombreux sports. Il a été ainsi décrit lors de la pratique de l’haltérophilie, de la musculation avec développé-couché, du judo, du ski nautique, mais aussi des sports de combat comme la lutte et la boxe, du football américain…
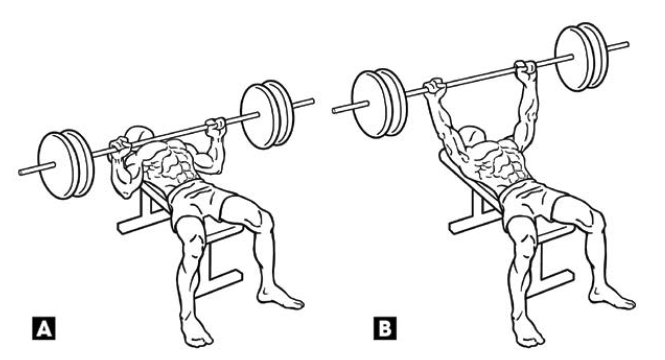
Dans cette étude anatomique, l’auteur démontra que, lors de l’extension de l’humérus à 30°, la portion abdominale du chef sternal du grand pectoral subissait un allongement disproportionné, allant de 30 à 45 % alors que les fibres des deux autres portions subissent un allongement de 20 à 25 %. L’étirement passif en l’état de contraction maximale produit de façon constante une rupture avec une longueur supérieure à 26 % de la longueur de repos.
L’électromyogramme confirme l’activation maximale du grand pectoral lors de l’initiation du développé-couché (Fig. 16), c’est-à-dire lorsque l’humérus est en extension. Il semble donc que la fréquence de rupture de l’insertion distale du grand pectoral s’explique selon l’hypothèse suivante : lorsque l’humérus est en extension, les fibres inférieures sont étirées au maximum, elles présentent un état de faiblesse mécanique important. Si un phénomène imprévu, déséquilibre de charge, charge exagérée, se présente, cela aboutit à une déchirure.
Effet des anabolisants et des suppléments protéiques
L’utilisation d’anabolisants et de suppléments protéiques majore le déséquilibre musculo-tendineux en augmentant artificiellement la puissance du compartiment musculaire sans véritablement permettre une augmentation de la résistance tendineuse.
L’anatomie des lésions
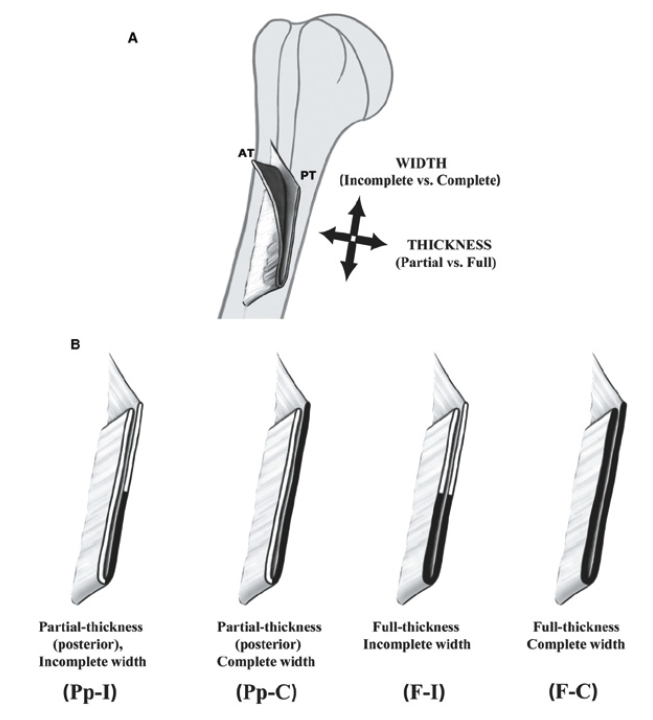
Elle a bien été précisée. Elle peut siéger à trois niveaux, proximal, c’est plutôt une désinsertion dans le corps charnu, ou distal.
L’atteinte distale est la règle. Elle peut intéresser le tendon lui-même, la jonction tendino-musculaire, consistant en une désinsertion de l’attache humérale. La déchirure du corps musculaire est inhabituelle. Il semblerait que la déchirure, quand elle est complète, s’effectue de bas en haut (Fig. 17).
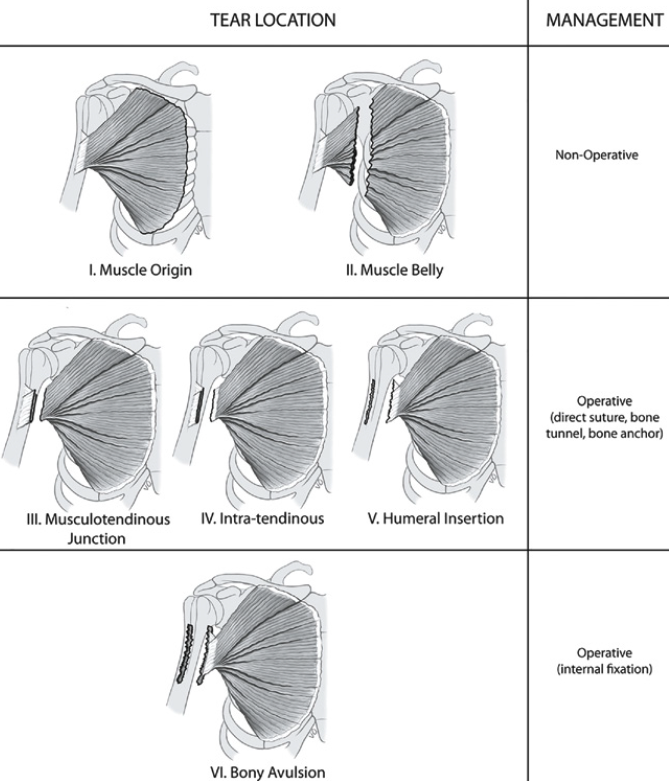
Dans un grand nombre de cas, la rupture est partielle. La classification selon Tierjen a le mérite de distinguer différentes situations cliniques et de codifier l’attitude thérapeutique (Fig. 18).
Les signes cliniques
À la phase aiguë, le patient ressent une douleur thoracique violente, à type de décharge ou de brûlure, un bruit particulier “snap ou pops” s’associe à une impotence fonctionnelle majeure surtout en adduction. Rapidement, un œdème avec une ecchymose envahit le sillon delto-pectoral gênant le diagnostic clinique.
Sur les pathologies fraîches, il faut signaler le fait que le diagnostic n’est pas toujours évident. Secondairement, la disparition de l’hématome fait place au défect musculo-tendineux, un sillon apparaît latéralement par rapport au corps musculaire et la déformation inesthétique de la paroi interpelle alors l’examinateur (Fig. 19).
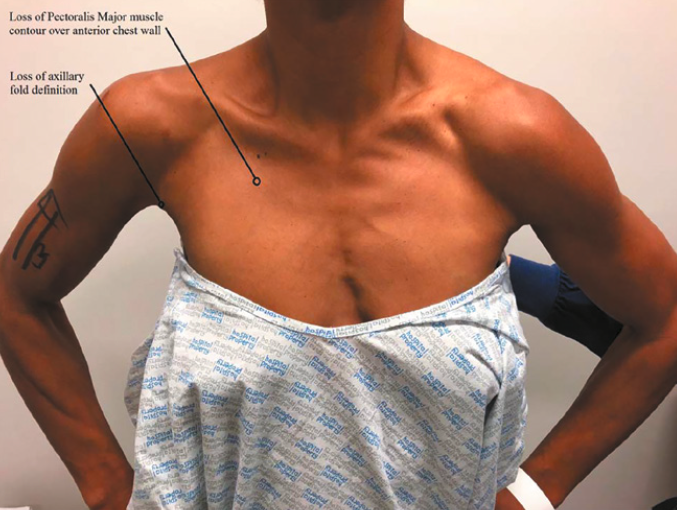
Le testing musculaire de l’épaule met en évidence un déficit de la force en adduction et rotation interne.
Les examens complémentaires
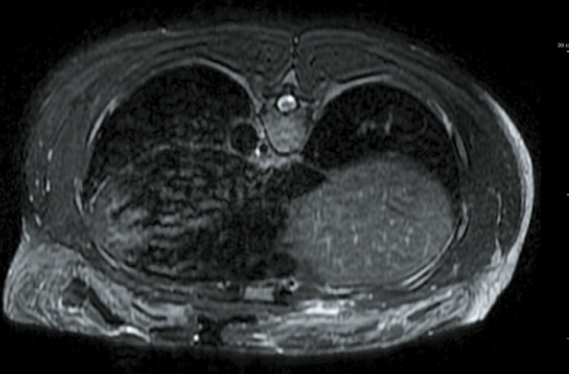
• L’échographie (Fig. 20) recherche la présence d’une collection hématique, apprécie le volume, retrouve une solution de continuité et le signe du battant de cloche signant la rupture.
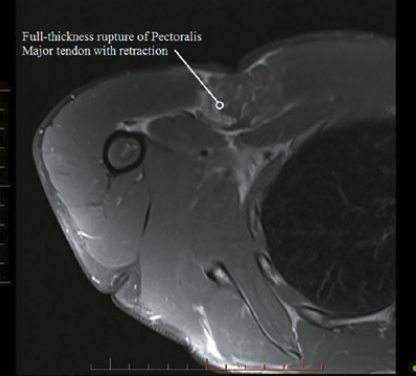
• L’IRM (Fig. 21) permet de visualiser également correctement les lésions. C’est l’examen de choix en pré-chirurgical.
Les lésions associées
• La rupture du grand pectoral s’associe fréquemment à un hématome qui peut s’enkyster ou s’infecter, responsable de douleur résiduelle.
• On a décrit des associations lésionnelles : rupture du deltoïde, du petit pectoral, lésion de la coiffe des rotateurs.
• Chez l’adolescent, il existe une forme particulière de rupture avec arrachement osseux au niveau de l’insertion distale du grand pectoral.
Diagnostics différentiels
• La rupture de la longue portion du biceps constitue une cause fréquente d’erreur, il en est de même de la lésion du sous-scapulaire.
• L’erreur la plus fréquente est de sous-estimer la gravité de la lésion du grand pectoral en retenant trop rapidement une contusion ou une lésion partielle.
• Des diagnostics plus exceptionnels sont possibles : fibro-myosarcome, lipome.
• Le syndrome de Poland est une maladie congénitale rare qui se traduit par diverses anomalies de développement affectant le thorax et le membre supérieur sur un seul côté du corps, trois fois sur quatre du côté droit. L’atrophie du grand pectoral, muscle thoracique le plus volumineux, est caractéristique de la maladie.
Le traitement
Il varie selon le type de lésion pour lequel la classification anatomique de Tierjen est pratique.
Cas du type 1
S’il s’agit d’un type 1 (contusion et élongation), il n’y a pas d’indication chirurgicale.
Cas du type 2
Pour le type 2 présentant une rupture partielle, là encore le traitement reste classique, repos ou immobilisation relative puis rééducation.
Cas du type 3
Le type 3, qui constitue la lésion la plus rare, dont le diagnostic est tardif, présente plusieurs formes.
La rupture de type 3A
La rupture type 3A correspond à une désinsertion de l’origine musculaire du grand pectoral sur le thorax. C’est la moins fréquente.
Le traitement conseillé est le repos et l’immobilisation, le bras en écharpe. La chirurgie permet parfois de drainer l’hématome associé.
La rupture de type 3 B
Conséquence d’un choc violent et direct, elle correspond à une lésion au niveau du corps musculaire en état de contraction. Cette lésion est une rupture complète de la portion charnue du grand pectoral.
Le traitement varie en fonction de l’importance de l’hématome. S’il est de faible volume, un traitement conservateur reste indiqué. S’il présente un volume important, son évacuation chirurgicale est recommandée avec essai de réparation musculaire.
La rupture des types 3C, 3D, 3E
C’est une rupture touchant essentiellement la jonction myo-tendineuse 3C et l’insertion tendineuse 3D. Ces lésions nécessitent un traitement chirurgical (Fig. 22).
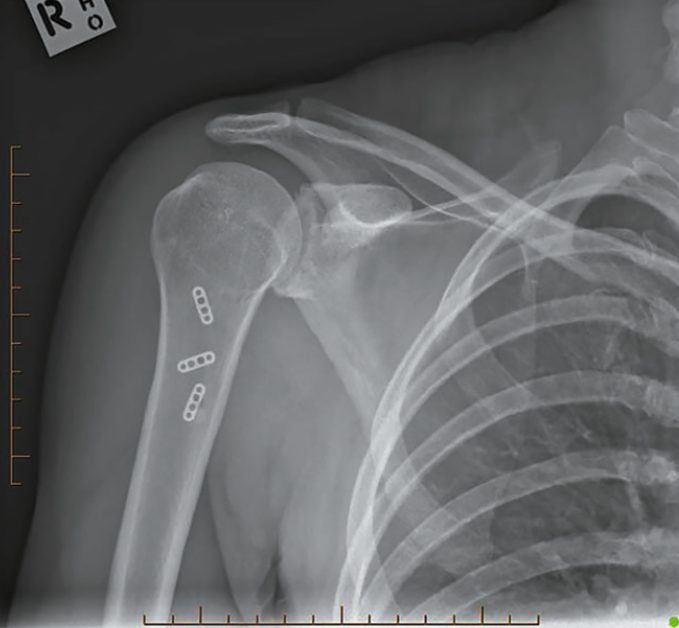
Les résultats
Les méta-analyses portant sur un grand nombre de cas, plus de 600, ont montré la supériorité du traitement chirurgical, sur le traitement médical. Dans un certain nombre de cas, des greffes ont été utilisées. Les complications ne sont pas négligeables entre 10 et 15 %. Les bénéfices sont importants, récupérations d’une force satisfaisante, esthétique préservée. Les résultats sont d’autant meilleurs que la chirurgie est plus précoce ; avant 6 semaines.
Une fixation solide du tendon sur l’humérus par l’utilisation d’ancrages intra-osseux et de sutures est obligatoire. L’immobilisation coude au corps sera de 6 semaines avant de mobiliser le bras. La reprise d’activité ne débutera pas avant 4 à 6 mois, dans l’attente d’une parfaite cicatrisation.
9/ Les autres muscles du thorax
Le petit pectoral (pectoralis minor)
Anatomie et rôles
Il s’insère sur le bord médial de la portion horizontale du processus coracoïde de la scapula. Il se dirige en bas en avant et en dedans pour se terminer sur la face antérieure des côtes 3, 4 et 5 près du cartilage costal. Il est innervé par le nerf pectoral médial (racines C8-T1) (Fig. 23 et 24).
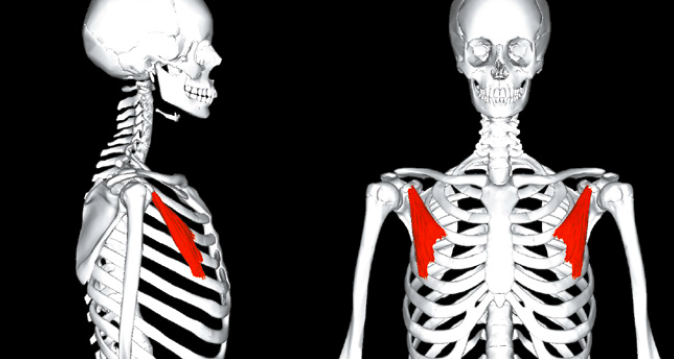
C’est un inspirateur profond accessoire qui augmente le volume thoracique, il plaque la scapula contre le gril costal et il a un rôle d’abducteur et d’antépulsion. Enfin, il est abaisseur de la scapula et rotateur interne de celle-ci.
Épidémiologie et étiopathogénie
Les variantes anatomiques sont fréquentes et une analyse de la littérature regroupant plus de 4 000 épaules a noté que des anomalies existaient dans près de 20 % des cas. La grande fréquence de ces anomalies anatomiques doit être connue, car elle peut induire en erreur à l’imagerie, compliquer une chirurgie éventuelle de la région, faciliter une pathologie secondaire. En 2019, une nouvelle étude avance même des chiffres d’anomalies des insertions du petit pectoral de près de 38 %. Pour les auteurs, les différentes techniques d’imagerie qu’il s’agisse d’échographie, de résonance magnétique d’arthro-IRM ne sont pas toujours suffisantes pour détecter ces anomalies.
Le petit pectoral joue un rôle essentiel dans la “fermeture” antérieure de la paroi thoracique en particulier chez les femmes du fait de la poitrine, d’autant qu’elle est volumineuse. Les techniques kinésithérapiques utilisées pour les pathologies d’épaule et du cou nécessitent toujours des manœuvres d’ouverture de la cage thoracique et notamment d’étirement du petit pectoral bien souvent contracturé.
La clinique
Le syndrome de compression du plexus brachial
Du fait de sa localisation, le petit pectoral peut participer à un syndrome de compression du plexus brachial sous-claviculaire. Nous n’évoquons pas aujourd’hui le syndrome du défilé qui nécessite un chapitre à part entière.
Les déchirures isolées
Les déchirures isolées du petit pectoral publiées sont rares. Elles se rencontrent le plus souvent dans l’haltérophilie ou les sports de contact, tels le football américain et le hockey sur glace. Elles doivent être incluses dans les diagnostics différentiels lors de l’évaluation de douleurs antérieures de l’épaule.
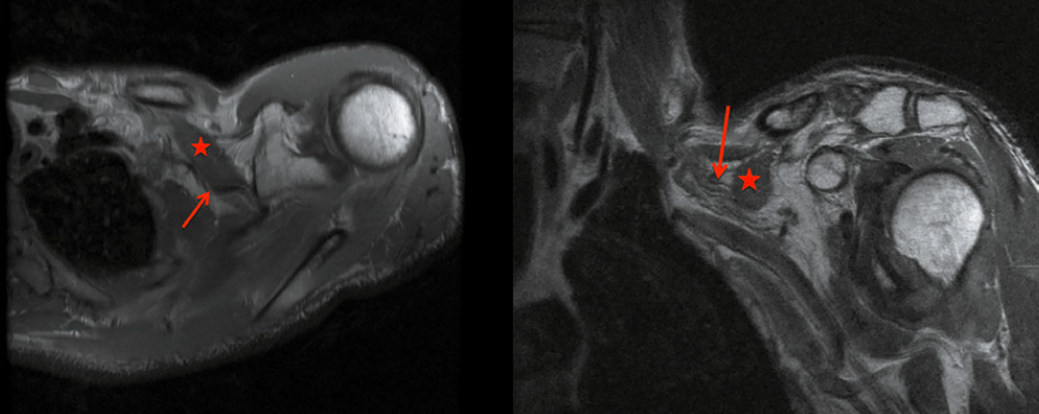
Un cas intéressant a été décrit chez une femme de 24 ans qui, lors d’un mouvement de type pompe latérale soutenue par son bras, a ressenti un pop et un claquement au niveau de son épaule à la partie antérieure et dans la poitrine. Lors de l’accident, la patiente avait tout son poids sur son bras gauche complètement tendu. L’examen physique initial a révélé une légère asymétrie du pli axillaire antérieur gauche sans déformation nette, sans ecchymose. Elle avait une sensibilité au niveau de la gouttière du biceps gauche et du tendon du grand pectoral avec douleur lors de la rotation interne du bras résisté. L’abduction et l’adduction scapulaires actives étaient douloureuses. La pointe de la coracoïde était sensible à la palpation. L’IRM a révélé une déchirure myotendineuse de grade 3 du petit pectoral avec rupture complète des fibres musculaires et béance visible des tissus, un liquide environnant à la jonction myotendineuse du petit pectoral avec un œdème musculaire adjacent (Fig. 25). Le complexe myotendineux du grand pectoral et le reste des tissus mous environnants n’ont montré aucune lésion. Le traitement conservateur comprenait du repos, de la glace, des anti-inflammatoires et une modification de l’activité. Après 2 semaines, la patiente a récupéré à 90 %.
À 3 semaines, elle avait repris des entraînements légers avec de l’aérobic et de la danse. Au suivi de 3 mois, la récupération était complète.
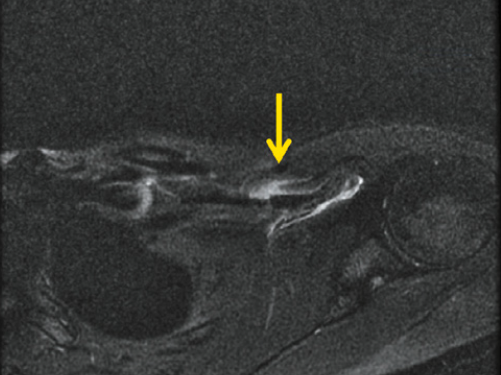
Le mécanisme exact de la rupture du tendon du petit pectoral est inconnu. Divers facteurs peuvent être retrouvés telles une tension excessive, une charge anormale et des forces excentriques, une fatigabilité. Une blessure peut survenir avec une force directe sur l’épaule ou un mouvement forcé du bras.
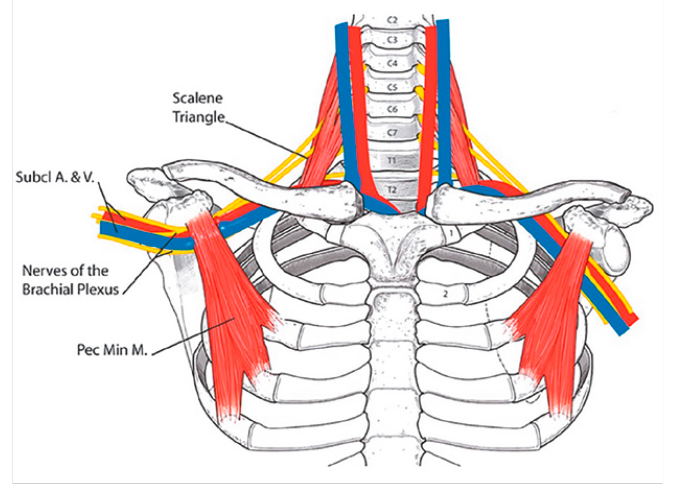
Le muscle sous-clavier (subclavius)
Anatomie et rôles
Le muscle sous-clavier est un muscle de petite taille situé à la partie supérieure du thorax antérieur. Son insertion s’effectue sur la clavicule dans une gouttière qui lui est propre ; il se dirige vers le bas en avant et en dedans et se termine sur la première côte et le cartilage sterno-costal. Son innervation est assurée par une branche collatérale directe du plexus brachial issu de C5.
En fonction de la fixité de l’insertion ou de la terminaison, il est un inspirateur profond en soulevant la première côte ou un abaisseur du moignon de l’épaule.
Épidémiologie et étiopathogénie
Ce muscle se trouve plutôt impliqué dans une pathologie que l’on peut regrouper dans « une entité compressive de la base du cou » : pathologie de la première côte, défilé des scalènes…
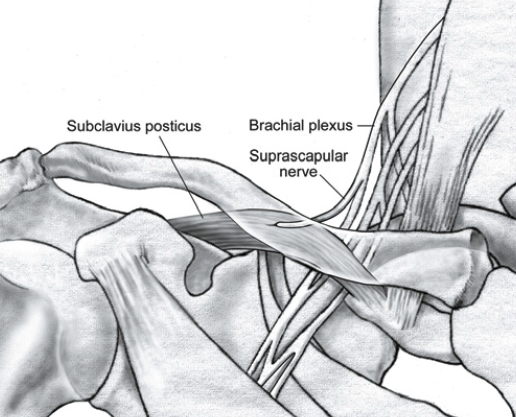
Le subclavius posticus
C’est un muscle anormal rare qui s’insère sur le cartilage costal de la première côte postéro-latérale et se termine sur le bord supérieur de l’omoplate. Suivant certaines dissections anatomiques, il serait présent dans 8 à 10 % des cas. Étant donné sa relation intime avec le plexus brachial, l’artère et la veine sous-clavière, il peut être une source de compression (Fig. 26 et 27). Il pourrait s’agir d’un facteur à l’origine du syndrome de Paget-von Schroetter, reconnu comme une thrombose spontanée ou liée à l’effort de la veine axillo-sous-clavière.
Bibliographie
6. La fracture de fatigue du sternum
• Choi P J, Iwanaga J, Tubbs R et al. A comprehensive review of the sternal foramina and its clinical significance. Cureus 2017 ; 9 : e1929.
• Lappe J, Cullen D, Haynatzki G et al. Calcium and vitamin d supplementation decreases incidence of stress fractures in female navy recruits. J Bone Miner Res 2008 ; 23 : 741-9.
• Keating TM. Stress fracture of the sternum in a wrestler. Am J Sports Med 1987 ; 15 : 92-3.
• McCurdle I, Etherington J, Buchanan N. Sternal fracture in a female army officer cadet. Br J Sports Med 1997 ; 31 : 164.
• Hill PF, Chatterji S, DeMello WF, Gibbons JR. Stress fracture of the sternum: an unusual injury? Injury 1997 ; 28 : 359-61.
• Swarup S, Bonomally K, Ansari MZ. Fracture of the sternum, an unusual case. Eur J Emerg Med 1999 ; 6 : 71-2.
• Barbaix EJ. Stress fracture of the sternum in a golf player. Int J Sports Med 1996 ; 17 : 303-4.
• Larson CM, Fischer DA. Injury to the developing sternum in an adolescent football player: a case report and literature review. Am J Orthop 2003 ; 32 : 559-61.
• Baker JC, Demertzis JL. Manubrial stress fractures diagnosed on MRI: report of two cases and review of the literature. Skeletal Radiol 2016 ; 45 : 833-7.
• Robertsen K, Kristensen O, Vejen L. Manubrium sterni stress fracture: an unusual complication of non-contact sport. Br Sport Med 1996 ; 30 : 176-7.
• Lee J, Fields KB. Sternal stress fracture in a middle-aged woman. BMJ Case Rep 2017 ; 2017 : brc2016218203.
• Poux D. Technopathies du golf. Paris : Insep édition, 1995.
7. La xiphodynie
• Akin K, Kosehan D, Topcu A, Kokterner A. Anatomic evaluation of the xiphoid process with 64-row multidetector computed tomography. Skeletal Radiol 2011 ; 40 : 447-52.
• Eid S, Iwanaga J, Oskouian RJ et al. Bifid xiphoid process: case report and review. Cureus 2018 ; 10 : e3153.
• Lachkar S, Iwanaga J, Tubbs RS. An elongated dorsally curved xiphoid process. Anat Cell Biol 2019 ; 52 : 102-4.
• Maigne JY, Vareli M, Rousset P, Cornelis P. Xiphodynia and prominence of the xyphoid process. Value of xiphosternal angle measurement: three case reports. Joint Bone Spine 2010 ; 77 ; 474-6.
• Hogerzeil DP, Hartholt KA, de Vries MR. Xiphoïdectomie: a surgical intervention for an under documented disorder. Case Rep Surg 2016 ; 2016 : 9306262.
• Brasseur JL. Échographie de la paroi thoracique antérieure. In: Rodineau J, Vuillemin V, Brasseur JL. Microtraumatologie du sport : de la clinique et de l’imagerie au traitement. Sauramps médical, 2019 : 115-59.
• Dorn P, Kuhn MA, Schweizer BA et al. Xiphoidectomy for intractable xiphodynia. World J Surg 2018 ; 42 : 3646-50.
8. La rupture du grand pectoral
• Bak K, Cameron EA, Henderson IJ. Rupture of the pectoralis major: a meta-analysis of 112 cases. Knee Surg Sports Traumatol Arthrosc 2000 ; 8 : 113-9.
• Balazs GC, Brelin AM, Donohue MA et al. Incidence rate and results of the surgical treatment of pectoralis major tendon ruptures in active-duty military personnel. Am J Sports Med 2016 ; 44 : 1837-43.
• Avery DM 3rd, Carolan GF, Festa A. Pectoralis major rupture in a 49-year-old woman. Am J Orthop 2014 ; 43 : E240-2.
• Sephien A, Orr J, Remaley DT. Pectoralis major tear in a 23-year-old woman while performing high-intensity interval training: a rare presentation. BMJ Case Rep 2020 ; 13 : e232649.
• ElMaraghy AW, Devereaux MW. A systematic review and comprehensive classification of pectoralis major tears. J Shoulder Elbow Surg 2012 ; 21 : 412-22.
• Dodds SD, Wolfe SW. Injuries to the pectoralis major. Sports Med 2002 ; 32 : 945-52.
• Stringer MR, Cockfield AN, Sharpe TR. Pectoralis major rupture in an active female. J Am Acad Orthop Surg Glob Res Rev 2019 ; 3 : e19.00030.
• Bodendorfer BM, McCormick BP, Wang DX, Looney AM et al. Treatment of pectoralis major tendon tears: a systematic review and meta-analysis of operative and nonoperative treatment. Orthop J Sports Med 2020 ; 8 : 2325967119900813.
• Bodendorfer BM, Wang DX, McCormick BP, Looney AM et al. Treatment of pectoralis major tendon tears: a systematic review and meta-analysis of repair timing and fixation methods meta-analysis. Am J Sports Med 2020 ; 48 : 3376-85.
• De Castro Pochini A, Andreoli CV, Belangero PS et al. Clinical considerations for the surgical treatment of pectoralis major muscle ruptures based on 60 cases: A prospective study and literature review. Am J Sports Med 2014 ; 42 : 95-102.
• Elliott BC, Wilson GJ, Kerr GK. A biomechanical analysis of the sticking region in the bench press. Med Sci Sports Exerc 1989 ; 21 : 450-62.
• Wolfe SW, Wickiewicz TL, Cavanaugh JT. Ruptures of the pectoralis major muscle: an anatomic and clinical analysis. Am J Sports Med 1992 ; 20 : 587-93.
• Tietjen R. Closed injuries of the pectoralis major muscle. J Trauma 1980 ; 20 : 262-4.
• Marsh NA, Calcei JG, Antosh IJ, Cordasco FA. Isolated tears of the sternocostal head of the pectoralis major muscle: surgical technique, clinical outcomes, and a modification of the Tietjen and Bak classification. J Shoulder Elbow Surg 2020 ; 29 : 1359-67.
• Kowalczuk M, Rubinger L, ElMaraghy AW. Pectoralis major ruptures: tear patterns and patient demographic characteristic. Orthop J Sports Med 2020 ; 8 : 2325967120969424.
9. Les autres muscles du thorax
• Zvijac JE, Zikria B, Botto-va, Bemden A. Isolated tears of pectoralis minor muscle in professional football players: a case series. Am J Orthop 2009 ; 38 : 145-7.
• Li X, Gorman MT, Dines JS, Limpisvasti O. Isolated tear of the pectoralis minor tendon in a high school football player. Orthopedics 2012 ; 35 : e1272-5.
• Kalra K, Neri B. Isolated pectoralis minor tendon tear in a professional ice hockey player-radiographic findings and presentation. Skeletal Radiol 2010 ; 39 : 1251-3.
• Mehallo CJ. Isolated tear of the pectoralis minor. Clin J Sport Med 2004 ; 14 : 245-6.
• Umehara J, Nakamura M, Fujita K et al. Shoulder horizontal abduction stretching effectively increases shear elastic modulus of pectoralis minor muscle. J Shoulder Elbow Surg 2017 ; 26 : 1159-65.
• Lawson GE, Hung LY, Ko GD, Laframboise MA. A case of pseudo–angina pectoris from a pectoralis minor trigger point caused by cross-country skiing. J Chiro Med 2011 ; 10 : 173- 8.
• Chen S, Yang D, Sun Q et al. Effect of pectoralis minor relaxation on the prognosis of rotator cuff injury under arthroscopy. Ann Palliat Med 2022 ; 11 : 77-84.
• Asghar A, Kant Narayan R, Satyam A, Naaz S. Prevalence of anomalous or ectopic insertion of pectoralis minor: a systematic review and meta-analysis of 4146 shoulders. Surg Radiol Anat 2021 ; 43 : 631-43.
• Loske S, Taha ME, Castens C et al. Isolated pectoralis minor tendon rupture with subclavian vein thrombosis. Case Rep Orthop 2021 ; 2021 : 8865592.
• Vance DD, Qayyum U, Jobin CM. Rare isolated pectoralis minor tear from a noncontact injury: case report and review of the literature. Case Rep Orthop 2019 ; 2019 : 3605187.
• Burley HEK, Haladaj R, Olewnik L et al. The clinical anatomy of variations of the pectoralis minor. Surg Radiol Anat 2021 ; 43 : 645-51.
• Akita K, Ibukuro K, Yamaguchi K. et al. The subclavius posticus muscle: a factor in arterial, venous or brachial plexus compression? Surg Radiol Anat 2000 ; 22 : 111-5.
• Cogar AC, Jonhsen PH, Potter HG, Wolfe SW. Subclavius posticus: an anomalous muscle in association with suprascapular nerve compression in an athlete. Hand 2015 ; 10 : 76-9.

