Les tendinopathies mécaniques – Ce qu’il faut savoir
Que sait-on aujourd’hui sur le tendon, sa structure, son fonctionnement, la compréhension de sa douleur, sa pathologie ?
Répondre à cette question de manière simple est difficile et pourtant essentiel pour un médecin du sport confronté en permanence à des tendinopathies variées.
1. Anatomie du tendon
Les fibres tendineuses
Les tendons courts
Les fibres tendineuses d’une extrémité à l’autre d’un tendon ont une direction parallèle à l’axe du tendon essentiellement sur les tendons courts, sur les tendons plats qui appartiennent à des muscles faibles, par exemple les extenseurs des doigts.
Les tendons longs
Les tendons longs, de forme globalement cylindrique, qui appartiennent à des muscles puissants, présentent des faisceaux avec un trajet hélicoïdal plus ou moins prononcé. Cette disposition spiralée confère au tendon, sans nuire à sa résistance, une certaine élasticité ; lorsque le pas de l’hélice s’allonge, l’effet est le même que celui produit par un ressort à boudin.
Architecture et composition
Les tendons sont constitués de cordons fibreux cylindriques ou aplatis qui relient les muscles aux pièces squelettiques (Fig. 1). Le collagène s’assemble en micro-fibrilles s’unissant elles-mêmes en fibrilles qui, une fois réunies, donnent naissance aux fibres ; plusieurs fibres intriquées forment des faisceaux primaires, secondaires et tertiaires. Le tendon comporte principalement une matrice extracellulaire composée de divers collagènes, de protéoglycanes, de glycoprotéine au sein de laquelle se situent des éléments cellulaires. Ils sont de type composite associant plusieurs fascicules de 10 à 1 000 séparés par des cloisons conjonctives.
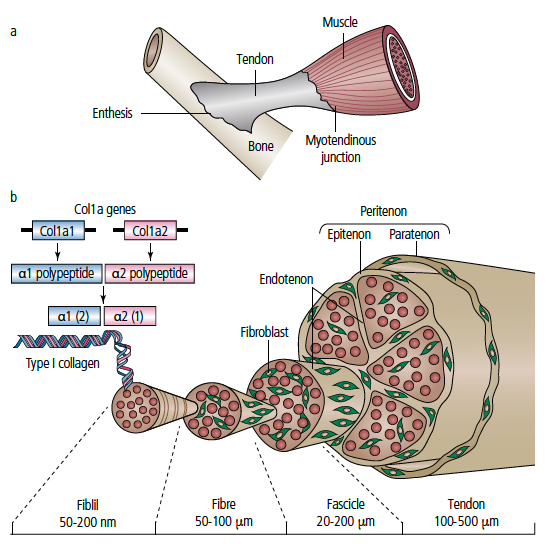
Le collagène principal de type 1 représente 95 % du collagène. Le collagène de type 3 intervient lors de la cicatrisation tendineuse. Environ 2 % de la masse sèche du tendon se compose d’élastine qui confère au tendon son élasticité originale (1).
Les fascicules tendineux
Il n’y a pas de rapport entre la section du tendon et la force du muscle correspondant, mais il en existe un entre la densité des fibres collagènes et la section des fascicules musculaires.
Un fascicule tendineux révèle des faisceaux épais de fibres collagènes remarquables par leur agencement disposé dans les trois plans de l’espace et comprenant en particulier des fibres obliques à 45°.
La jonction tendon-os
À l’une de ses extrémités, le tendon se continue avec le muscle et son aponévrose et, à l’autre, il s’insère sur une pièce osseuse ou cartilagineuse.
En cas d’insertion cartilagineuse
Les fibres du tendon pénètrent le périchondre, dont elles ne peuvent être dissociées, puis la substance fondamentale dans laquelle elles se perdent. Il en résulte l’apparition d’une zone intermédiaire d’aspect fibro-cartilagineux.
En cas d’insertion du tendon sur une pièce osseuse
Dans cette situation, la plus fréquente, les fibres les plus périphériques se mêlent à celles du périoste qui est interrompu au pourtour de l’insertion tendineuse. Les fibres centrales connues sous le nom de fibres de Sharpey vont pénétrer la corticale et se perdre dans la substance osseuse.
Cette organisation structurelle avec progression des différentes couches histologiques permet d’harmoniser la transmission des forces entre les muscles et l’os.
Le trajet du tendon
En regard des zones de réflexion, le tendon possède une structure histologique spécifique avec plusieurs couches distinctes : un bourrelet de glissement, une couche de pression, une couche de traction.
Les fissures
Les tendons court et long fibulaires présentent souvent des fissures longitudinales ; de même, le tendon du chef long biceps brachial dans le sillon inter-tubérositaire est aplati et naturellement fissuré. Ces fissures sont souvent interprétées à tort comme pathologique. On les nomme également lames de fasciculations. Ces fissures permettent au tendon de s’adapter aux changements rapides et inégaux de volume et facilitent la déformation du tendon.
Les tendons de traction et de pression
Les tendons de traction ont des faisceaux arrondis. Les tendons de pression sont plus aplatis et ovalaires. À la suite de travaux expérimentaux, il a été constaté qu’on pouvait transformer la structure histologique des tendons de traction en tendons de pression (2, 3).
Résistance mécanique
75 % du poids du tendon humain est constitué de collagène. Au repos, la surface du tendon est ondulée. L’allongement du collagène avant rupture est de 10 %, celui de l’élastine de 100 %. La résistance mécanique du tendon est quatre fois supérieure à celle du muscle en tension isométrique. Chez des adolescents sportifs, la pratique d’une activité physique nécessitant des sauts et des impulsions participe à l’augmentation significative de l’épaisseur du tendon rotulien.
On estime qu’il existe une cinquantaine de tendons humains différents et des forces de rupture situées entre 15 000 et 17 000 kilos par centimètre carré. La rupture survient habituellement à la jonction entre la zone tendino-aponévrotique et le muscle ou à la jonction tendino-osseuse.
La vascularisation du tendon
La disposition macroscopique des artères à destination tendineuse se concentre sous la forme d’un méso-tendon, véritable hile vasculaire. Le réseau vasculaire intra-tendineux se dispose sous forme d’échelle avec de très nombreuses anastomoses.
La vascularisation des jonctions
La vascularisation des zones de jonction est très spécifique. Au niveau de la jonction musculo-tendineuse, les artères se poursuivent dans le tendon avec des anastomoses variables. À la jonction ostéo-tendineuse, les artères sont filiformes sans trajet fixe. Il n’existe aucune communication artérielle entre le tendon et l’insertion sur l’os. On note une zone avasculaire de tissu osseux minéralisé.
L’innervation du tendon
Elle s’effectue par la présence de terminaisons nerveuses. On peut les considérer comme un capteur de mesure de tension qui intervient dans la régularisation de la contraction musculaire. Ce sont les organes nerveux terminaux musculo-tendineux de Golgi. La topographie des terminaisons nerveuses dans les tendons est différente selon qu’il s’agit des extenseurs ou des fléchisseurs. Les structures nerveuses les plus fréquentes sont les corpuscules de Vater-Pacini situés à proximité des tendons.
Les structures péri-tendineuses
La gaine conjonctive
Le tendon est enveloppé durant une grande partie de son trajet par une gaine conjonctive qui facilite son déplacement. Elle présente deux feuillets : l’un interne s’applique contre le tendon, l’autre externe est en continuité avec les plans conjonctifs périphériques. Aux deux extrémités, les deux feuillets se continuent l’un avec l’autre et en fermant la cavité et délimitent un repli qui se déroule au cours des mouvements de flexion et d’extension.
Les gaines fibreuses
Les gaines fibreuses, notamment des doigts, permettent de maintenir le tendon sur tout son trajet. Les poulies fibreuses, qui entourent partiellement le tendon, s’insèrent sur des segments osseux et constituent des gaines ostéo-fibreuses péri-tendineuses. Leur rôle est de maintenir le tendon axé, de favoriser son glissement, d’augmenter le rendement mécanique et d’économiser l’énergie. Elles peuvent être communes à plusieurs tendons, ou propres à un tendon.
L’aponévrose
Elle est située à la superficie des muscles. Parfois elle glisse sur certains d’entre eux au moyen d’un tissu cellulaire filamenteux lâche. Cette aponévrose se poursuit à l’intérieur du muscle par des cloisons et des coulées conjonctives qui séparent les divers faisceaux des fascicules musculaires et permettent la pénétration des éléments vasculaires.
Lors d’un mouvement passif, l’aponévrose se déforme préférentiellement dans le sens de la longueur. Lors des contractions musculaires, c’est l’inverse qui se produit, la déformation est plus importante dans le sens de la largeur. Elle joue un rôle essentiel dans l’allongement du muscle.
Les bourses conjonctives
Ce sont des structures interposées entre un élément osseux et un élément tendineux. Elles obéissent au principe mécanique de protection entre deux structures de consistance différente. On les retrouve par exemple entre le calcanéum et le tendon calcanéen, entre les têtes des métatarsiens.
2/ Les tendinopathies
Les mécanismes lésionnels du tendon
Le tendon peut souffrir suivant trois modalités.
Un conflit ou un coincement
Le tendon peut présenter un conflit intrinsèque :
• avec une structure anatomique de voisinage, normale, le trajet du tendon étant modifié par une anomalie morphologique, un trouble statique ;
• par une structure anatomique pathologique tels un rétinaculum épaissi, une calcification, une excroissance osseuse.
Le conflit extrinsèque se produit avec un matériel inadapté, une chaussure par exemple.
Les frottements répétés vont entraîner d’abord une pathologie péri-tendineuse de la gaine ou d’une bourse de glissement.
Une traction excessive (overuse)
La tendinopathie survient de manière brutale ou le plus souvent du fait de microtraumatismes répétés. La résistance à la traction du tendon est dépassée. Le défaut de résistance peut être en rapport avec une faiblesse constitutionnelle du tendon, de l’enthèse, d’une fragilisation par des lésions dégénératives préexistantes ou d’une modification de l’axe de travail du tendon. On retient la notion d’une modification rapide excessive de l’activité ou d’une surcharge, c’est-à-dire un changement rapide en résistance (4).
Une contusion par traumatisme direct
Le tendon présente une impaction d’intensité variable, fréquemment tendon d’Achille, tendons des épicondyliens.
Les facteurs favorisants d’altération
Un certain nombre de facteurs favorisent l’altération du tendon, il est indispensable de les connaître pour les dépister et les éviter.
L’âge
Avec l’âge, le contenu en eau et en protéoglycanes décroît ; il en est de même de la vascularisation du tendon. Ces phénomènes s’accélèrent après 60 ans, notamment l’activité des ténocytes, l’élasticité et la résistance diminuent (5, 6). La capacité d’adaptation du tendon est réduite imposant des temps de repos et de récupération plus longs.
Le genre féminin
Une partie de cette différence de risque de blessure entre les hommes et les femmes s’explique probablement par les différences hormonales sexuelles, qui sont spécifiquement distinctes au cours de la maturation sexuelle à l’adolescence et au début de l’âge adulte (6).
Chez les femmes, la présence d’œstrogènes peut être bénéfique lors du chargement régulier du tissu ou lors de la récupération après une blessure, car les œstrogènes augmentent le taux de synthèse du collagène tendineux. Cependant, chez les jeunes athlètes actives, une concentration physiologique élevée d’œstrogènes peut augmenter le risque de blessures en raison d’une réticulation fibrillaire réduite et d’une laxité articulaire accrue (7).
L’augmentation de la masse corporelle
Lors de la course à pied, un coureur de fond pesant 70 kg absorbe au moins 220 tonnes par mile. Le coureur qui parcourt 100 miles, soit 160 km, par semaine pose chaque pied environ 3 millions de fois par an. La force de l’impact augmente avec la vitesse (8, 9).
L’obésité est un facteur connu d’altération tendineuse et ces altérations ne concernent pas uniquement les tendons des membres inférieurs (10). Les tendons des patients obèses sont relativement pauvres en petites fibres de collagène, ce qui est le témoin d’un remodelage altéré. On y trouve des gouttelettes lipidiques et leur architecture est modifiée. Des facteurs biochimiques interviennent également et sont responsables d’une inflammation chronique à bas bruit.
Les anti-inflammatoires non stéroïdiens
Les études de bonne qualité sont relativement peu nombreuses. Il n’existerait pas d’effet délétère dans les processus de cicatrisation, pas de modification formelle dans les délais de reprise de la pratique sportive (11).
Les infiltrations de cortisone
Les injections de corticoïdes intra-tendineuses sont délétères, elles peuvent faciliter la rupture notamment des tendons fonctionnellement majeurs. L’association corticoïdes-anesthésiques locaux pourrait majorer la toxicité.
En revanche, les injections péri-tendineuses ne semblent pas avoir d’effet délétère. Certains tendons ont été bien étudiés, notamment les épicondyliens. De façon formelle, les injections de corticoïdes ont de bons résultats à court terme, par contre les risques de récidive sont très importants et, à distance, les résultats pour les auteurs semblent identiques avec un traitement corticoïde et un traitement de type wait and see ; l’avantage étant même donné à l’absence de thérapeutique.
Les facteurs génétiques
Il est incontestable que certains sujets font plus facilement des tendinopathies que d’autres pour un même niveau d’activité et dans les mêmes conditions d’entraînement. Certains sujets ayant une hyperlaxité généralisée d’origine génétique sont plus sujets que d’autres (12, 13).
Le tabagisme
C’est un facteur connu. Les ruptures de coiffe et les ruptures distales du biceps brachial sont en effet plus fréquentes chez les fumeurs. Le tabac a également un rôle négatif sur la cicatrisation tendineuse (14).
L’inactivité
L’immobilisation articulaire entraîne des modifications du tendon, il existe une diminution de la résistance mécanique. Une mobilisation précoce augmente la résistance (15, 16).
Les problèmes dentaires
Même si cela n’a pas été formellement démontré, un certain nombre d’études semblent pointer du doigt l’association de souffrances tendineuses et d’infections dentaires (17).
Les produits toxiques
Les molécules en cause
Plusieurs médicaments présentent une toxicité spécifique pour les tendons (18, 19). Ce sont les inhibiteurs de l’aromatase, les antibiotiques de la classe des quinolones, les glucocorticoïdes (schémas thérapeutiques à long terme) et les statines.
La tendinopathie toxique chez l’homme a été liée de manière moins systématique au traitement par stéroïdes anabolisants, agents antirétroviraux (principalement des inhibiteurs de protéase), inhibiteurs de la métalloprotéinase (MMPI) et isotrétinoïne.
Présentation clinique
Les tendinopathies classiques induites par un médicament apparaissent comme une “tendinose” (c’est-à-dire une dégénérescence progressive du tendon sans inflammation), bien que les cas associés à des inhibiteurs de l’aromatase présentent principalement une ténosynovite. N’importe quel tendon peut être touché, mais les fluoroquinolones, les glucocorticoïdes et les statines affectent le plus souvent les gros tendons porteurs du membre inférieur, en particulier le tendon calcanéen, qui peut se rompre dans environ 30 à 40 % des cas.
Les facteurs de risque
Des facteurs de risque avérés ont été identifiés tels que l’âge supérieur à 60 ans, une tendinopathie préexistante et la potentialisation des effets toxiques lorsque plusieurs classes de médicaments sont utilisées en association.
La pathogénie
Le délai d’apparition des symptômes varie de quelques jours (fluoroquinolones) à des semaines, des mois, voire des années. La pathogénie est mal comprise, mais les mécanismes proposés incluent l’apoptose des ténoblastes et des ténocytes, une fonction ténocytaire déficiente conduisant à une maintenance et une réparation anormale de la matrice extracellulaire ainsi qu’une perturbation de la signalisation intercellulaire. On retrouve une désintégration structurelle via une combinaison d’augmentation de l’expression d’enzymes lytiques, une diminution du taux de cholestérol dans les membranes cellulaires et une néoangiogenèse dans un tissu tendineux hautement ordonné.
L’étiopathogénie de la tendinopathie
L’étiologie de la pathogénie des tendinopathies est mal connue. Nous ne connaissons pas vraiment l’évolution naturelle d’une tendinopathie et son processus de guérison.
Le modèle de Cook
Dans deux articles, qui font référence dans la littérature actuelle, Cook, en 2009 (20) et 2016 (21), décrit le modèle de « continuum de tendinopathie ». Fort de la description anatomique et de l’expérience clinique, il évoque une évolutivité de l’état du tendon avec quatre stades anatomiques qui sont interchangeables et réversibles dans le temps en fonction des individus et de la charge de travail (Fig. 2 et 3) :
1. le tendon normal,
2. le tendon réactif,
3. le tendon dysréactif,
4. la tendinopathie.
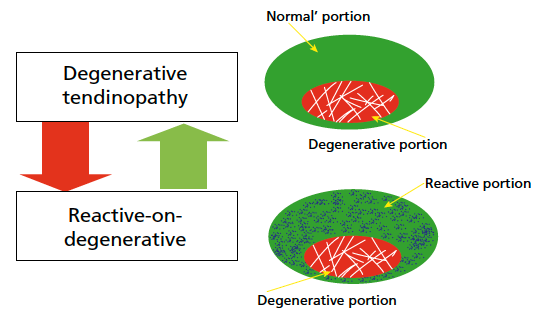
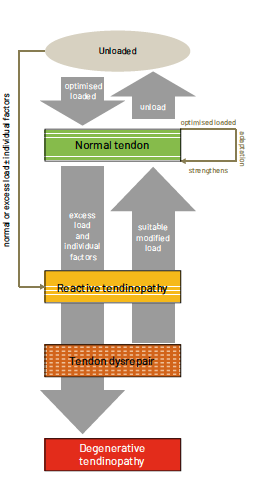
Il essaye d’établir une relation entre la structure du tendon, son fonctionnement et la douleur. L’objectif du modèle du continuum de 2009 est triple :
• exprimer la capacité variée des tendons pathologiques à se rétablir,
• établir les facteurs structurels qui limitent le retour à l’indolence
• et proposer des interventions adaptées aux besoins des patients et au stade de la pathologie.
L’étiopathogénie
Pour expliquer la pathogénie de la tendinopathie, Cook émet trois hypothèses.
Le déchirement du collagène
L’hypothèse du déchirement du collagène est la plus ancienne, peut-être la plus contestable, car les fibres de collagène normales ne peuvent se déchirer in vivo sans altération substantielle de la matrice non collagénique.
L’inflammation et les cytokines
La place de l’inflammation dans la tendinopathie est complexe. Une réponse inflammatoire classique dans le tendon est la suivante : on observe une rupture ou une lacération d’un tendon et de son irrigation sanguine. La réponse des tissus à une agression chimique ou mécanique entraîne une réponse immunitaire importante des cellules et des ténocytes, elle augmente la production de protéines et la taille des tendons. Bien que des cellules inflammatoires aient été observées dans des cas de tendons pathologiques, la réponse ne semble pas être une réponse traditionnelle. Les cytokines inflammatoires sont régulées à la hausse (souvent 1 000-10 000 fois) dans les modèles de choc systémique et les modèles animaux utilisant des injections d’endotoxines. Dans le cadre d’une pathologie microtraumatique, l’augmentation moyenne est de 1,5 fois. Peut-on alors parler d’inflammation ? Les cytokines sont pléiotropes. La même cytokine peut avoir des actions différentes sur différentes cellules. Elle peut avoir des effets opposés à des concentrations faibles et élevées. Différentes cytokines peuvent produire le même effet, leur rôle et leur effet dans tous les tissus est complexe et pas toujours inflammatoire.
Le ténocyte
Le modèle de réponse des cellules tendineuses est le ténocyte, principal responsable du maintien de l’activité extracellulaire en réponse à son environnement. Ainsi, l’évolution de la charge tendineuse et le milieu biochimique seront détectés par les ténocytes responsables d’une cascade de réponses (activation cellulaire, expression des protéoglycanes et changements dans le type de collagène).
La réversibilité
Pour expliquer cette réversibilité, l’auteur explique qu’au temps T il existe des zones saines et des zones pré-pathologiques, qui ne sont pas capables d’absorber la charge de travail du tendon. En fonction de différents facteurs, le tendon devient douloureux (ou pas ?) et évoluera avec une transformation de son métabolisme et de son anatomie.
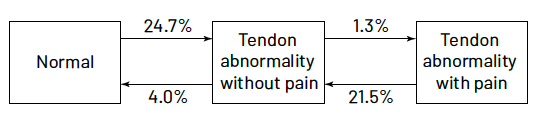
Cas d’une équipe de volley-ball
Malliaras (24) a suivi pendant une saison une équipe de volley-ball, il réalise des échographies des tendons rotuliens à ses joueurs tous les mois. Il compare les anomalies détectées en échographie et les douleurs décrites par les joueurs et conclut qu’au cours d’une saison, lorsque l’activité est la plus intense, les douleurs tendineuses (knee jumper) et les anomalies échographiques peuvent s’accroître et se résorber (Fig. 4).
Les mécanismes de la douleur
Anatomie
L’identité du conducteur nociceptif dans la tendinopathie n’est pas clairement identifiée. Anatomiquement, quatre types de terminaisons nerveuses sont connues au niveau des tendons :
• les corpuscules de Ruffini,
• les terminaisons nerveuses libres,
• les corpuscules de Pacini, principalement au niveau du tendon
• et les organes du tendon de Golgi, principalement au niveau du muscle.
Relation entre la structure du tendon, son fonctionnement et la douleur
Une réversibilité existe entre un tendon normal, un tendon réactif et un tendon dégénératif (26). Les parties dégénératives du tendon, parfois non vues en imagerie traditionnelle, apparaissent mécaniquement silencieuses et structurellement incapables de transmettre la charge de traction. Cela peut entraîner une surcharge dans la partie normale du tendon. Ainsi, ce dysfonctionnement altère la structure du tendon sain qui évoluera vers une tendinopathie réactive. Si la charge et le mode de travail sont modifiés, cet état structurel du tendon est réversible.
Une imagerie plus performante et des études prospectives seront nécessaires pour identifier les facteurs structurels (c’est-à-dire le degré de désorganisation).
La variabilité de la structure au fil du temps est importante dans le développement de la douleur. Ceci met en évidence la complexité de l’interaction entre la structure, la douleur et la fonction que le clinicien rencontre souvent (27, 28). Langberg met en évidence une augmentation de la synthèse du collagène de type 1, donc élément de normalisation, avec un travail excentrique sur le tendon d’Achille (29).
Interventions mécaniques ciblant la douleur
Thérapeutique
Sur le plan thérapeutique, nous disposons de beaucoup de moyens pour traiter une tendinopathie : les anti-inflammatoires non stéroïdiens, les injections de corticostéroïdes, la thérapie par ondes de choc extracorporelles, l’injection de sang total, la thérapie PRP (plasma riche en plaquettes), le sérum physiologique et beaucoup d’autres thérapies injectables, non injectables, manuelles. Ces traitements réduisent la douleur à court et moyen termes. L’efficacité à long terme est mise en doute. Bien qu’il soit essentiel de s’attaquer à la douleur, ces interventions ont un effet minime sur la cinétique entre le tendon et le muscle, aucun effet sur les déficits de la chaîne musculaire, il existe donc un risque potentiel de récidive de la douleur.
Mécano-transduction
Les contractions isométriques
Les contractions musculaires isométriques du quadriceps pour une tendinopathie rotulienne induisent une analgésie immédiate et réduisent l’inhibition corticale du muscle, qui à son tour améliore la force (30, 31). L’effet antalgique peut être obtenu durant 2 à 8 heures en réalisant des contractions isométriques lourdes à 70 % de la puissance maximale tenue 45 à 60 secondes répétées quatre fois. Cet exercice peut être répété dans la journée et s’inscrit dans une logique de réhabilitation et reconstruction tendineuse (32, 33). Ce programme d’exercices en charge a l’avantage de favoriser le fonctionnement de la chaîne tendon/muscle, mais aussi le contrôle cortical du muscle, qui peut conduire à des améliorations de fonction et un résultat clinique positif. Ce programme de réhabilitation en charge est capable de modifier l’équilibre entre l’excitabilité et l’inhibition dans le contrôle musculaire (34) modifiant ainsi les charges transmises par le tendon.
La régulation de l’activité sportive
Les tendons rotuliens et achilléens sont les plus étudiés par leur fréquence lors des sports de saut et de course. Pour réduire la douleur, il faut une régulation de l’activité sportive, car la complète cessation de l’activité aurait un effet délétère sur la capacité de résistance à l’effort du tendon. On peut moduler la dose, la fréquence et l’intensité de l’entraînement sans l’arrêter complètement (35).
Le renforcement excentrique (38-41)
Les protocoles d’exercices excentriques pour les tendons achilléens et rotuliens, bien décrits par les équipes scandinaves, offrent des résultats intéressants sur le plan clinique et structurel, même s’ils varient d’un auteur à l’autre. Le mécanisme de leur action antalgique n’est pas clair, mais la mécano-transduction des ténocytes est probable. Les tendons s’adaptent aux altérations mécaniques en changeant leur structure et leur composition par l’intermédiaire des ténocytes. Ils réagissent aux forces mécaniques en modifiant leur gêne et les modes d’expression, la synthèse des protéines et le phénotype cellulaire (36-38), qui peut être utilisé pour faciliter le processus de guérison.
Les programmes de renforcement excentrique peuvent être efficaces dans la prise en charge de la tendinopathie du corps principal du tendon d’Achille. Stanish a introduit le concept d’entraînement excentrique dans la réadaptation des blessures aux tendons au milieu des années 1980 (40), et les auteurs scandinaves l’ont popularisé plus d’une décennie plus tard, avec quelques différences importantes. Stanish recommande d’effectuer les exercices excentriques sans douleur, au contraire des auteurs scandinaves.
Les résultats d’exercices excentriques observés dans d’autres pays sont moins convaincants que ceux rapportés par les groupes d’étude de Scandinavie, avec seulement environ 60 % de bons résultats. Les différentes publications à ce jour démontrent que le programme excentrique est probablement une gestion utile de la tendinopathie, mais les preuves sont actuellement insuffisantes pour suggérer qu’il est supérieur ou inférieur à d’autres formes d’exercices thérapeutiques.
Une signalisation paracrine
La forte relation entre douleur du tendon et charge mécanique, en tenant compte de la mécano-réactivité de ténocytes, peut impliquer une signalisation paracrine par les cellules tendineuses comme facteur potentiel de nociception. Ces substances peuvent sensibiliser les mécanorécepteurs périphériques proches ou dans le péri-tendon en stimulant le nerf périphérique induisant alors un stimulus de douleur. Ceci peut expliquer pourquoi la pathologie peut survenir plus profondément dans le tendon sans douleur tendineuse, car cette région est éloignée de la région de l’innervation nerveuse. Le tendon indolore peut contenir une matrice substantielle et des anomalies cellulaires, mais une production limitée de substance nociceptive. Ainsi, ce tendon a une capacité de signalisation ou une activation des récepteurs, ce qui est en résumé un stimulus nociceptif.
Le rôle du système nerveux central
Enfin, le rôle du système nerveux central dans la modulation de la nociception est reconnu et décrit. Un programme de rééducation fait travailler le tendon, le muscle, le contrôle cortical de ce muscle est ainsi modifié, ce qui peut conduire à des améliorations de la fonction et un résultat clinique positif.
Un programme de rééducation fondé sur la charge est capable de modifier l’équilibre entre l’excitabilité et l’inhibition dans le contrôle musculaire, modifiant ainsi les charges transmises par le tendon.
Décrypter les voies de la mécano-transduction, comprendre la réponse cellulaire et biochimique engendrée est un préalable à la conception de thérapies nouvelles et pertinentes pour orienter une tendinopathie plus rapidement sur une cicatrisation durable et solide.
La vascularisation dans les tendinopathies mécaniques
Une hypervascularisation
Lors des tendinopathies, on a envie de parler d’hypervascularisation, car un tendon normal est faiblement vascularisé. On peut présumer que les sportifs asymptomatiques qui présentent une hypervascularisation en Doppler couleur ou Doppler puissance après exercices ont une tendinopathie débutante (42).
Effet du traitement excentrique
Cette hypervascularisation traduit sans doute une surcharge mécanique du tendon. Une tendinopathie qui évolue favorablement sous traitement excentrique voit sa vascularisation diminuer, ce qui serait lié au fait que l’exercice excentrique va occlure les vaisseaux (43).
Hypervascularisation et douleur
L’hypervascularisation est souvent corrélée à la douleur en raison d’une néo-innervation associée, mais elle n’est pas toujours retrouvée dans les tendons symptomatiques. Sa présence est plus spécifique d’une tendinopathie symptomatique que les modifications écho-structurales seules. Elle est plus marquée aux endroits de douleurs maximum. Elle ne constitue pas un facteur pronostique pour l’évolution après traitement.
Anatomopathologie et classification
Des lésions anatomiques très variées
Les lésions anatomiques d’un tendon peuvent être très variées, tous les cas de figure se rencontrent : fissure intra-tendineuse, dissections lamellaires, rupture fasciculaire…
Il est important de comprendre que les différents faisceaux des tendons pluri-fasciculaires ne subissent pas les mêmes contraintes mécaniques et on constate fréquemment sur les tendons de la coiffe des rotateurs, du moyen fessier, du tendon patellaire des lésions concernant seulement certains faisceaux superficiels ou profonds latéraux ou médiaux antérieurs ou postérieurs suivant l’anatomie du tendon. Le tendon du supra-spinatus présente un mode de fonctionnement différent suivant qu’il s’agit des fibres superficielles ou profondes.
Les éléments systématiques retrouvés
Parmi les éléments systématiquement retrouvés dans les tendinopathies chroniques :
• au niveau du collagène : désorganisation des fibres, séparation, micro-ruptures, majoration des fibres de type 3
par rapport au type 1, qui est normalement largement le plus important ;
• au niveau des ténocytes : augmentation du nombre, modification de la morphologie, augmentation de l’apoptose ;
• au niveau de la substance fondamentale : augmentation de celle-ci par majoration des protéoglycanes et des GAG, dégénérescence mucoïde, vacuoles entre les fibres, anomalies de vascularisation et d’innervation du tendon.
Il est à noter qu’il n’existe pas de lésion inflammatoire. Sur un plan macroscopique, le tendon pathologique est normalement blanc et luisant ; lorsqu’il s’altère, il devient gris et amorphe. Microscopiquement, les fibres de collagène sont discontinues et désorganisées.
Les lésions chroniques
La prolifération fibroblastique et la néo-angiogenèse sans cellule inflammatoire ont rendu le terme de tendinite inappropriée pour définir ses formes chroniques au moins à l’échelon cellulaire, ce qui n’est peut-être pas le cas à l’échelon moléculaire ou dans les phases aiguës sur des lésions chroniques. Il semble exister des médiateurs chimiques inflammatoires lors de la phase initiale du processus lésionnel des tendons.
La biologie moléculaire
La biologie moléculaire du tendon est extrêmement complexe. Il existe plusieurs types de collagène, la matrice extracellulaire contient également divers protéoglycanes et glycoprotéines qui représentent par exemple 5 % du poids sec du tendon. Divers enzymes sont partie prenante dans le remodelage du tendon.
Le processus lésionnel
Le schéma classique largement décrit n’est sans doute pas la règle.
• J1-J3 : infiltration de polynucléaires et de macrophages avec œdème, puis bourgeonnement capillaire. Cette première phase et de courte durée, de 4 à 7 jours.
• J4 : activation des fibroblastes et des myofibroblastes permettant la formation d’un tissu de granulation.
• J4-J21 : le premier collagène formé est de type 3, mal organisé et plus fragile que le collagène de type 1 qui commence alors à le remplacer à partir du 12e-14e jour.
• À partir de la 3e semaine : la force aux résistances de tension augmente. Un cal tendineux se forme environ au 30e jour, puis progressivement une phase de remodelage s’étend sur 1 an, voire plus.
• À 3 mois de la lésion initiale : le tendon garde encore un déficit de résistance à la traction qui peut atteindre 30 %. La maturation du collagène et le réalignement des fibres surviennent entre le 5e et le 6e mois.
• À 12 mois : la récupération des propriétés biomécaniques se fait au bout de 12 mois selon certains auteurs mais, pour d’autres, elle n’est jamais complète avec un déficit permanent de 20 à 30 %.
L’importance d’une mobilisation précoce et prudente, la stimulation en traction des fibroblastes, le travail excentrique semblent favorables (44-47).
La réparation de l’enthèse
Le processus de réparation de l’enthèse est moins bien étudié. Sa régénération paraît plus difficile à obtenir. La lésion de la barrière fibro-cartilagineuse favorise la colonisation du tendon par des cellules osseuses créant une ossification cicatricielle, enthésophyte, qui peut être vulnérante pour le tendon, en tout cas moins fonctionnel, favorisant ainsi la chronicité.
Cela pose différents problèmes : faut-il réparer l’enthèse, la supprimer, en créer une autre ?
3/ L’examen clinique du tendon en souffrance
Il existe une check-list qui permet de poser un diagnostic, de définir les examens complémentaires et sans doute d’orienter le traitement.
L’interrogatoire
Le mode de survenue et les antécédents
On définit dans un premier temps le mode de survenue, qui est habituellement progressif, mais qui, de manière paradoxale, peut parfois être explosif et, dans ce cas, il faut être attentif à une éventuelle lésion grave. Toute modification est essentielle à dépister : intensité d’entraînement, modification des techniques, modification du matériel. On définit également les antécédents, une éventuelle récidive. La prise récente de médicaments doit systématiquement être recherchée : traitement antibiotique avec quinolones, statines…
La localisation
La localisation doit être précisée par le patient et le praticien à la fois pour définir le tendon et sa zone de souffrance.
Le rythme de la douleur
Le rythme de la douleur doit être mécanique. Il faut se méfier en particulier chez les sujets jeunes d’une participation inflammatoire notamment au niveau des enthèses qui, parfois, ne s’impose pas d’emblée.
Les classifications cliniques des stades douloureux
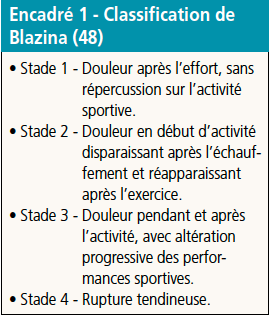
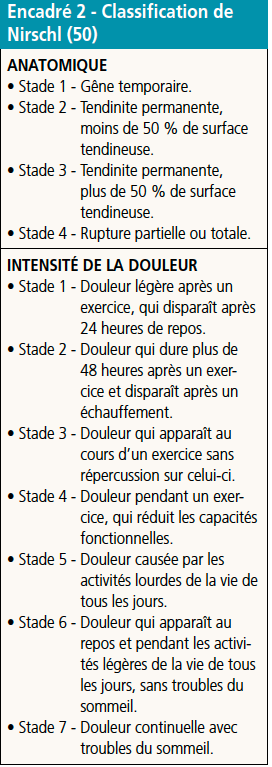
Un certain nombre d’auteurs ont défini des classifications cliniques, pour catégoriser l’intensité de la souffrance tendineuse (Encadrés 1 et 2) (48-50).
L’examen physique
Le diagnostic d’une lésion tendineuse est le résultat d’une enquête, parfois “policière”, qui nécessite une connaissance anatomique précise.
Le bilan clinique et la palpation
Le bilan clinique complet de l’articulation dans laquelle s’insère le tendon est incontournable pour rechercher une douleur projetée ou une pathologie associée.
La palpation retrouve la zone douloureuse, parfois un gonflement, un crépitement, une zone nodulaire.
L’étirement et la contraction isométrique
L’étirement est un test logique, mais souvent théorique. Il fait pourtant partie de l’examen clinique complet et peut orienter vers des solutions thérapeutiques.
La contraction isométrique reste incontournable pour analyser un tendon, mais, suivant les tendons, il faut être capable de choisir des tests associés, de s’adapter.
La pointe de rotule
La tendinite de pointe de rotule avec une souffrance du tendon à son insertion nécessite, compte tenu de la puissance de ce tendon, un travail isométrique en charge avec variation des différents angles de flexion pour réveiller le phénomène douloureux.
Le tendon du supra-épineux
La souffrance du tendon du supra-épineux est difficile, car il n’existe aucun test absolument spécifique (on en a décrit 140 !) et on a volontiers recours un recoupement de tests pour pouvoir cibler le tendon.
Le tendon du long biceps
Le tendon du long biceps à la partie haute est lui aussi fort difficile à analyser comme tendent à le prouver les différentes manœuvres pour constater sa souffrance.
Le tendon de l’ECU
Le tendon de l’ECU est bien mieux révélé dans ses phénomènes douloureux par un mécanisme de supination forcée active que par les tests de contractions contre résistance témoignant en l’occurrence d’un phénomène d’instabilité plus ou moins important.
L’examen morphostatique
L’examen morphostatique est tout particulièrement important chez les sportifs qui sont amenés à effectuer des gestes répétitifs avec des charges, des vitesses angulaires, des positionnements souvent extrêmes.
On recherche les rétractions en positionnant l’articulation sus et sous-jacente pour limiter les compensations, on contrôle, en charge, les appuis plantaires, les axes, les inégalités de longueur. On sait par exemple que les dyskinésies de l’omoplate peuvent être à moyen terme un facteur favorisant des souffrances tendineuses. Un pied valgus exagéré peut, chez un marathonien, décompenser le jambier postérieur.
Les tests isocinétiques et biomécaniques
Les tests isocinétiques ont permis de manière objective de contrôler l’équilibre naturel des muscles d’un segment. On est aujourd’hui capable de contrôler le rapport entre des ischio-jambiers trop faibles et un quadriceps trop puissant et ainsi le rééquilibrer.
De même, des laboratoires de biomécanique sont aujourd’hui capables de manière de plus en plus précise d’analyser des gestes dans leur ensemble et de contrôler que les différents maillons de la chaîne cinétique sont harmonieux. Le geste technique, même s’il est efficace, engendre souvent, s’il n’est pas correct, des pathologies à plus ou moins longue échéance notamment tendineuses.
L’analyse du matériel
L’analyse du matériel, qu’il s’agisse de chaussures, de raquette, de club…, doit faire l’objet d’un véritable fitting.
Les examens complémentaires
L’échographie et le Doppler couleur
Il s’agit d’un merveilleux outil pour l’étude des tendons. Elle démontre en effet, avec une définition inégalée par les autres techniques, la structure interne du tendon, particulièrement depuis l’apparition de sondes de très haute fréquence. La technique étant non irradiante et non invasive, elle permet une étude systématique controlatérale comparative. Elle permet également une étude dynamique qui est irremplaçable pour l’étude de certains tendons comme l’ECU.
L’association du Doppler couleur permet de déceler des modifications locales souvent symptomatiques qui présagent d’une importante souffrance. Les progrès de cette technique permettent de détecter des anomalies morphologiques discrètes au niveau des tendons. Celles-ci sont fréquentes chez des personnes qui, par ailleurs, n’ont pas de plaintes cliniques. Il convient de rester prudent dans l’interprétation des images et de ne pas nécessairement les banaliser. La description des altérations, sans passer directement à la conclusion, reste importante pour le clinicien, qui les intégrera au reste des données. Peut-être pourra-t-il aussi proposer une approche thérapeutique “préventive” pour ces tendons présentant des altérations minimes ?
Les autres outils
D’autres outils peuvent être utiles telle la radiographie en cas de calcifications, et bien sûr l’IRM avec ses différentes coupes et séquences.
4/ Les thérapeutiques
Les thérapeutiques médicales
Elles sont nombreuses. Certaines innovantes telles le PRP, les produits sclérosants sont toujours à la recherche de résultats incontestables.
Le contrôle cortico-spinal du muscle
Certaines voies de recherches nouvelles sont intéressantes. Elles s’adressent au contrôle cortico-spinal du muscle. Le terme “contrôle cortico-spinal du muscle” fait référence à l’activation de l’unité motrice résultant des entrées cortico-spinales excitatrices et inhibitrices dans le pool de motoneurones spinaux, ce qui affecte finalement le stress tendineux et la performance motrice. L’entraînement en force est un puissant modulateur du système nerveux central. Les apports cortico-spinaux sont essentiels pour le recrutement et l’activation des unités motrices.
La neuroplasticité
Cependant, les paramètres spécifiques d’entraînement en force sont importants pour la neuroplasticité. Il a été démontré que l’entraînement en force, qui est stimulé de l’extérieur et s’apparente à un mouvement contrôlé, non seulement réduit la douleur tendineuse, mais module le contrôle excitateur et inhibiteur du muscle et, par conséquent, la charge potentielle du tendon. Une meilleure compréhension des méthodes qui maximisent les possibilités de neuroplasticité peut être une avancée importante dans la façon dont nous prescrivons une rééducation fondée sur l’exercice dans la tendinopathie pour la modulation de la douleur et potentiellement la restauration du contrôle cortico-spinal du complexe muscle-tendon.
La bilatéralité
Pour les auteurs, compte tenu de la fréquente bilatéralité des lésions, en particulier aux membres inférieurs, il est indispensable de traiter les deux côtés. L’entraînement de résistance stimulé par l’extérieur, comme avec l’utilisation d’un métronome, est capable d’induire des changements ipsilatéraux et controlatéraux de l’excitabilité et de l’inhibition chez les participants sains (51-53).
Il a également été démontré que l’entraînement en force stimulé de l’extérieur est capable de moduler la douleur des tendons et le contrôle du muscle par les voies cortico-spinales.
Conclusion
Le muscle et son aponévrose sont les moteurs du mouvement. Le tendon est l’organe de transmission. Il est formé de fibres, comporte une matrice composée en particulier de collagène, de cellules et de capteurs de tension qui conditionnent son fonctionnement et donnent quelques clés pour comprendre les mécanismes de la douleur. Décrypter les voies de la mécano-transduction, comprendre la réponse cellulaire et biochimique engendrée est un préalable à la conception de thérapies nouvelles et pertinentes pour orienter une tendinopathie plus rapidement sur une cicatrisation durable et solide. Les conditions de déclenchement et d’évolution d’une tendinopathie sont multiples, la notion de continuum apporte un nouvel éclairage. Pour l’exploration des tendons, l’échographie est une technique irremplaçable qui nécessite cependant d’être affinée pour devenir également un instrument pronostique. En dehors des thérapeutiques déjà connues, la sollicitation du système cortico-spinal mérite d’être explorée.
Bibliographie
1. Sharma P, Maffulli N. Tendinopathy and tendon injury: the future. Disabil Rehabil 2008 ; 30 : 1733-45.
2. Sick H. L’adaptation des tendons à la réflexion. Arch Anat Hist Emb Exp 1964 : 47 ; 370-446.
3. Rigby BJ. Effect of cyclic extension on the physical properties of tendon collagen and its possible relation to biological ageing of collagen. Nature 1964 ; 202 : 1072.
4. Leadbetter WB. Cell-matrix response in tendon injury. Clin Sports Med 1992 ; 11 : 553-78.
5. Almekinders LC, Deol G. The effects of aging, anti-inflammatory drugs, and ultrasound on the in vitro response of tendon tissue. Am J Sports Med 1999 ; 27 : 417-21.
6. Frizziero A, Vittadini F, Gasparre G, Maslero S. Impact of oestrogen deficiency and aging on tendon: concise review. Muscles Ligaments Tendons J 2014 ; 4 : 324-8.
7. Hansen M, Kjaer M. Sex hormones and tendon. Adv Exp Med Biol 2016 ; 920 : 139-49.
8. Järvinen M, Józsa L, Kannus P et al. Histopathological findings in chronic tendon disorders. Scand J Med Sci Sports 1997 ; 7 : 86-95.
9. Taunton JE, Ryan MB. A retrospective case-control analysis of 2002 running injuries. Br J Sports Med 2002 ; 36 : 95-101.
10. Abate M. How obesity modifies tendons (implications for athletic activities) Muscles Ligaments Tendons J 2014 ; 4 : 298-302.
11. Weiler JM. Medical modifiers of sports injury. The use of nonsteroidal anti-inflammatory drugs (NSAIDs) in sports soft-tissue injury. Clin Sports Med 1992 ; 11 : 625-44.
12. Bard H. Hyperlaxité et sport. Rhumatologie 1996 ; 48 : 129-35.
13. Collins M, Raleigh SM. Genetic risk factors for musculoskeletal soft tissue injuries. Med Sport Sci 2009 ; 54 : 136-49.
14. Abate M, Vanni D, Pantalone A, Salini V. Cigarette smoking and musculoskeletal disorders. Muscles Ligaments Tendons J 2013 ; 3 : 63-9.
15. Bayer ML, Schjerling P, Herchenhan A et al. Release of tensile strain on engineered human tendon tissue disturbs cell adhesions, changes matrix architecture, and induces an inflammatory phenotype. PLoS One 2014 ; 9 : e86078.
16. Couppé C, Suetta C. The effects of immobilization on the mechanical properties of the patellar tendon in younger and older men. Clin Biomech 2012 ; 27 : 949-54.
17. Gallagher J, Ashley P, Petrie A, Needleman I.
Oral health and performance impacts in elite and professional athletes. Community Dent Oral Epidemiol 2018 ; 46 : 563-8.
18. Bolon B. Mini-review: toxic tendinopathy. Toxicol Pathol 2017 ; 45 : 834-37.
19. Kirchgesner T, Larbi A, Omoumi P et al. Drug-induced tendinopathy: from physiology to clinical applications. Joint Bone Spine 2014 ; 81 : 485-92.
20. Cook JL, Purdam CR. Is tendon pathology a continuum? A pathology model to explain the clinical presentation of load-induced tendinopathy. Br J Sports Med 2009 ; 43 : 409-16.
21. Cook JL, Rio E, Purdam CR, Docking SI. Revisiting the continuum model of tendon pathology: what is its merit in clinical practice and research? Br J Sports Med 2016 ; 50 : 1187-91.
22. Cook JL, Feller JA, Bonar SF et al. Abnormal tenocyte morphology is more prevalent than collagen disruption in asymptomatic athletes’ patellar tendons. J Orthop Res 2004 ; 22 : 334-8.
23. Hamilton B, Purdam C. Patellar tendinosis as an adaptive process: a new hypothesis. Br J Sports Med 2004 ; 38 : 758-61.
24. Malliaras P, Cook J. Prospective study of change in patellar tendon abnormality on imaging and pain over a volleyball season. Br J Sports Med 2006 ; 40 : 272-4.
25. Jozsa L, Balint J, Kannus P et al. Mechanoreceptors in human myotendinous junction. Muscle Nerve 1993 ; 16 : 453-7.
26. Rudavsky A, Cook J. Physiotherapy management of patellar tendinopathy (jumper’s knee). J Physiother 2014 ; 60 : 122-9.
27. Edwards S, Steele JR, McGhee DE et al. Landing strategies of athletes with an asymptomatic patellar tendon abnormality. Med Sci Sports Exerc 2010 ; 42 : 2072-80.
28. Mann KJ, Edwards S, Drinkwater EJ et al. A lower limb assessment tool for athletes at risk of developing patellar tendinopathy. Med Sci Sports Exerc 2013 ; 45 : 527-33.
29. Langberg H, Ellingsgaard H, Madsen T et al. Eccentric rehabilitation exercises increase peritendinous type I collagen synthesis in humans with Achilles tendinosis. Scand J Med Sci Sports 2007 ; 17 : 61-6.
30. Rio E, Kidgell D, Purdam C et al. Isometric exercise induces analgesia and reduces inhibition in patellar tendinopathy. Br J Sports Med 2015 ; 49 : 1277-83.
31. Kongsgaard M, Qvortrup K, Larsen J et al. Fibril morphology and tendon mechanical properties in patellar tendinopathy: effects of heavy slow resistance training. Am J Sports Med 2010 ; 38 : 749-56.
32. Kubo K, Ikebukuro T, Yata H et al. Time course of changes in muscle and tendon properties during strength training and detraining. J Strength Cond Res 2010 ; 24 : 322-31.
33. Latella C, Kidgell DJ, Pearce AJ. Reduction in corticospinal inhibition in the trained and untrained limb following unilateral leg strength training. Eur J Appl Physiol 2012 ; 112 : 3097-107.
34. Naugle KM, Fillingim RB, Riley 3rd JL. A meta analytic revew of the of the hypoalgesic effects exercice. J Pain 2012 ; 13 ; 1139-50.
35. Cook JL, Purdam CR. The challenge of managing tendinopathie in competing athletes. Br J Sports Med 2014 ; 48 ; 506-9.
36. Hampson K, Forsyth NR, El Haj A, Maffulli N. Tendon tissue engineering. In: Ashammakhi N, Reis R, Chiellini F, eds. Topics in tissue engineering, Vol. 4. 2008 ; 1-21.
37. Wang JH. Mechanobiology of tendon. J Biomech 2006 ; 39 : 1563-82.
38. Maffulli N, Walley G. Eccentric calf muscle training in athletic patients with Achilles tendinopathy. Disabil Rehabil 2008 ; 30 : 1677-84.
39. Roos EM, Engstrom M, Lagerquist A, Soderberg B. Clinical improvement after 6 weeks of eccentric exercise in patients with mid-portion Achilles tendinopathy – a randomized trial with 1-year follow-up. Scand J Med Sci Sports 2004 ; 14 : 286-95.
40. Stanish WD, Rubinovich RM, Curwin S. Eccentric exercise in chronic tendinitis. Clin Orthop Relat Res 1986 ; 208 : 65-8.
41. Rompe JD, Nafe B, Furia JP, Maffulli N. Eccentric loading, shock-wave treatment, or a wait-and-see policy for tendinopathy of the main body of tendon Achillis: a randomized controlled trial. Am J Sports Med 2007 ; 35 : 374-83.
42. Boesen AP, Boesen MI. Associations between abnormal ultrasound color Doppler measures and tendon pain symptoms in badminton players during a season: a prospective cohort study. Am J Sports Med 2012 ; 40 : 548-55.
43. De Vos RJ, Heijboer MP. Weinans H et al. Tendon structure’s lack of relation to clinical outcome after eccentric exercises in chronic midportion Achilles tendinopathy. J Sport Rehabil 2012 ; 21 : 34-43.
44. Evans RB. Managing the injured tendon: current concepts. J Hand Ther 2012 ; 25 : 173-89.
45. Regan W, Wold LE, Coonrad R, Morrey BF. Microscopic histopathology of chronic refractory lateral epicondylitis. Am J Sports Med 1992 ; 20 : 746-9.
46. Fyfe I, Stanish WD. The use of eccentric training and stretching in the treatment and prevention of tendon injuries. Clin Sports Med 1992 ; 11 : 601-24.
47. Bard H, Briard JL, Stanish WD. Tendinopathies d’origine mécanique du genou. In: De Seze, Ryckwaert A. L’actualité rhumatologique 1984. Paris, Expansion scientifique française : 92-9.
48. Blazina ME, Kerlan RK, Jobe FW et al. Jumper’s knee. Orthop Clin North Am 1973 ; 4 : 665-78.
49. Ferretti A, Puddu G, Mariani PP, Neri M. The natural history of jumper’s knee. Patellar or quadriceps tendonitis. Int Orthop 1985 ; 8 : 239-42.
50. Ellenbecker TS, Nirschl R, Renstrom P. Current concepts in examination and treatment of elbow tendon injury. Sports Health 2013 ; 5 : 186-94.
51. Weier AT, Pearce AJ, Kidgell DJ. Strength training reduces intracortical inhibition. Acta Physiol 2012 ; 206 : 109-19.
52. Pearce AJ, Hendy A, Bowen WA et al. Corticospinal adaptations and strength maintenance in the immobilized arm following 3 weeks unilateral strength training. Scand J Med Sci Sports 2013 ; 23 : 740-8.
53. Rio E, Kidgell D, Moseley GL et al. Tendon neuroplastic training: changing the way we think about tendon rehabilitation: a narrative review. Br J Sports Med 2016 ; 50 : 209-15.